Bài giảng Phản ứng oxi hóa khử được trích từ khóa học Học tốt Hóa 10 của thầy Lâm Mạnh Cường gồm: Số oxi hóa, Chất oxi hóa và chất khử, Phản ứng oxi hóa khử, Phương pháp thăng bằng electron.
1. Số oxi hóa
Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi xem tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn, ký hiệu ±n.
Số oxi hóa của nguyên tử được xác định trực tiếp từ công thức phân tử theo các quy tắc sau:
– Trong đơn chất, số oxi hóa của mọi nguyên tử đều bằng 0.
– Trong hợp chất, số oxi hóa của hydrogen là +1, của oxygen là –2, của kim loại IA là +1, của kim loại IIA là +2, của Al là +3, (trừ các trường hợp đặc biệt: OF2, Na2O2, KO2, NaH, CaH2, …).
– Trong hợp chất, tổng số oxi hóa của các nguyên tử bằng 0.
– Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion.
– Trong ion đa nguyên tử, tổng số oxi hóa của nguyên tử bằng điện tích ion.
2. Chất oxi hóa và chất khử
Chất oxi hóa là chất nhận electron, quá trình oxi hóa là quá trình làm tăng số oxi hóa của chất bị oxi hóa và làm giảm số oxi hóa của chất oxi hóa.
Chất khử là chất nhường electron, quá trình khử là quá trình làm giảm số oxi hóa của chất bị khử và làm tăng số oxi hóa của chất khử.
3. Phản ứng oxi hóa khử
Phản ứng oxi hóa khử là loại phản ứng hóa học mà trong đó có sự thay đổi số oxi hóa.
Phương trình phản ứng oxi hóa khử thường được cân bằng theo phương pháp thăng bằng electron: Tổng số electron chất khử nhường luôn bằng với tổng số electron chất oxi hóa nhận.
Phương pháp thăng bằng electron gồm các bước sau:
– Xác định nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa và chất khử.
– Viết các bán phản ứng biểu diễn quá trình oxi hóa và quá trình khử.
– Nhân các bán phản ứng với các hệ số sao cho số electron nhường và nhận bằng nhau.
– Đặt các hệ số trên vào phương trình rồi cân bằng các chất còn lại.
Bài tập nền tảng về Phản ứng oxi hóa khử
Câu 1: Số oxi hóa đặc trưng cho đại lượng nào sau đây của nguyên tử trong phân tử?
A. Hóa trị. B. Điện tích. C. Khối lượng. D. Số hiệu.
Câu 2: Trong một phản ứng oxi hóa khử, chất oxi hóa là chất
A. nhường electron. B. nhận electron.
C. nhận proton. D. nhường proton.
Câu 3: Dãy nào sau đây được sắp xếp theo chiều giảm dần số oxi hóa của nguyên tử Cl?
A. Cl2, HCl, KClO3, HClO4. B. HClO4, KClO3, HCl, Cl2.
C. HClO4, KClO3, Cl2, HCl. D. Cl2, KClO3, HCl, HClO4.
Câu 4: Khi tham gia các phản ứng đốt cháy nhiên liệu, O2 đóng vai trò là
A. chất khử. B. base. C. acid. D. chất oxi hóa.
Câu 5: Cho các phân tử có công thức cấu tạo sau:
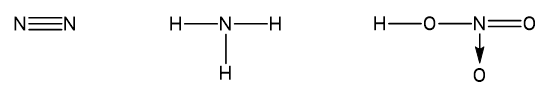
Xác định số oxi hóa của nguyên tử N trong các phân tử trên.
Câu 6: Xác định số oxi hóa của tất cả các nguyên tử trong các chất sau:
Cu F2 MnO2 C4H10 KBr H2O2 KNO3 Na2S2O3 K2Cr2O7 KClO4 NH4Cl
Li+ Cl– Co3+ O2– NO2– CO32– AlO2– H5S2+ PO43– ClO3– HSO4–
Câu 7: Trong các phản ứng sau, phản ứng nào là phản ứng oxi hóa khử? Xác định chất oxi hóa và chất khử, quá trình oxi hóa, quá trình khử trong các phản ứng đó.
Zn + CuSO4 → ZnSO4 + Cu
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
2H2S + 3O2 → 2SO2 + 2H2O
2Cu + O2 + 2H2SO4 → 2CuSO4 + 2H2O
NaOH + HCl → NaCl + H2O
2NH3 + 3CuO → 3Cu + N2 + 3H2O
2KClO3 → 2KCl + 3O2
Cl2 + 2NaOH → NaCl + NaClO + H2O
Fe2O3 + CO → 2FeO + CO2
2AgNO3 + BaCl2 → 2AgCl + Ba(NO3)2
Câu 8: Cân bằng các phản ứng oxi hóa khử sau bằng phương pháp thăng bằng electron.
NH3 + Br2 → N2 + HBr
Cu + H2SO4(đặc) → CuSO4 + SO2 + H2O
C2H5OH + O2 → CO2 + H2O
NaCl + H2O → NaOH + Cl2 + H2
NO2 + O2 + H2O → HNO3
HNO3 + H3AsO3 → NO + H3AsO4 + H2O
FeS2 + O2 → Fe2O3 + SO2
NH4ClO4 → N2 + Cl2 + O2 + H2O
KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O
Cr(OH)3 + Br2 + NaOH → Na2CrO4 + NaBr + H2O
Câu 9: Dẫn từ từ khí SO2 vào 100 mL dung dịch KMnO4 0,02 M đến khi dung dịch mất màu tím. Phản ứng xảy ra theo sơ đồ sau: SO2 + KMnO4 + H2O → H2SO4 + K2SO4 + MnSO4. Xác định thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn.
Câu 10: Cho 2,34 g kim loại M tác dụng với dung dịch H2SO4 (đặc, nóng, dư), thu được 3,2227 L khí SO2 (điều kiện chuẩn). Xác định kim loại M.
Các ảnh lời giải sau được trích một phần từ khóa học online Học tốt Hóa 10
Luyện tập về Phản ứng oxi hóa khử
Câu 1: Phát biểu nào sau đây là đúng?
A. Số oxi hóa của nguyên tử trong bất kỳ một đơn chất nào đều bằng 0.
B. Tổng số oxi hóa của tất cả nguyên tử trong một phân tử và trong một ion đa nguyên tử đều bằng 0.
C. Trong tất cả các hợp chất, hydrogen luôn có số oxi hóa là +1.
D. Trong tất cả các hợp chất, oxygen luôn có số oxi hóa là –2.
Câu 2: Phản ứng oxi hóa khử là phản ứng có sự nhường và nhận
A. electron. B. neutron. C. proton. D. cation.
Câu 3: Cho phản ứng: Ca + Cl2 → CaCl2. Kết luận nào sau đây đúng?
A. Mỗi nguyên tử Ca nhận 2 electron.
B. Mỗi nguyên tử Cl nhận 2 electron.
C. Mỗi phân tử Cl2 nhường 2 electron.
D. Mỗi nguyên tử Ca nhường 2 electron.
Câu 4: Sục từ từ khí SO2 vào dung dịch KMnO4 thì thấy màu tím của dung dịch nhạt dần rồi mất, sản phẩm sinh ra gồm MnSO4 và H2SO4. Nguyên nhân là
A. SO2 đã oxi hóa KMnO4 thành MnSO4.
B. SO2 đã khử KMnO4 thành MnSO4.
C. KMnO4 đã khử SO2 thành H2SO4.
D. H2O đã oxi hóa KMnO4 thành MnSO4.
Câu 5: Cho các phân tử có công thức cấu tạo sau:
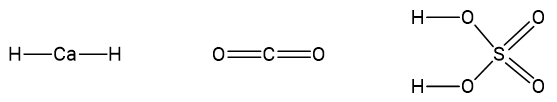
Xác định số oxi hóa của tất cả nguyên tử trong các phân tử trên.
Câu 6: Xác định số oxi hóa của tất cả các nguyên tử trong các chất sau:
Cr S8 CaH2 C3H8 Li3N HIO4 B2H6 RbClO4 MnSO4 KClO2 CaHAsO4
Zn2+ N3– Pt4+ Se2– IO4– NH2– GaH4– Fe(OH)2+ CoO43– MnO42– PbCl42–
Câu 7: Trong các phản ứng sau, phản ứng nào là phản ứng oxi hóa khử? Xác định chất oxi hóa và chất khử, quá trình oxi hóa, quá trình khử trong các phản ứng đó.
PCl3 + Cl2 → PCl5
CO2 + 2LiOH → Li2CO3 + H2O
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Br2 + SO2 + 2H2O → 2HBr + H2SO4
NH4Cl → NH3 + HCl
C4H10 → CH4 + C3H6
2NaN3 → 2Na + 3N2
3MnO2 + 4Al → 3Mn + 2Al2O3
4KO2 → 2K2O + 3O2
3HNO3 + Ag3PO4 → 3AgNO3 + H3PO4
Câu 8: Cân bằng các phản ứng oxi hóa khử sau bằng phương pháp thăng bằng electron.
SO2 + O2 → SO3
NaI + HOCl → NaIO3 + HCl
CH4 + O2 → CO2 + H2O
Al + H2SO4(đặc) → Al2(SO4)3 + SO2 + H2O
NO2 + O2 + H2O → HNO3
NaOH + Br2 → NaBr + NaBrO3 + H2O
CO + I2O5 → CO2 + I2
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + H2O
(COOH)2 + KMnO4 + H2SO4 → MnSO4 + CO2 + H2O + K2SO4
Câu 9: Điền vào chỗ trống trong đoạn thông tin sau:
Phản ứng Fe2O3 + 3CO 2Fe + 3CO2 xảy ra trong quá trình luyện gang, thuộc loại phản ứng ………………………. vì có sự thay đổi …………………. của các nguyên tố ……………. Trong đó, CO là chất ………………, C+2 …………. electron và Fe2O3 là chất ………………, Fe+3 …………. electron.
Câu 10: Trong công nghiệp, H2SO4 được sản xuất từ quặng pirite sắt có thành phần chính là FeS2 theo sơ đồ sau: FeS2 → SO2 → SO3 → H2SO4.
(a) Hoàn thành sơ đồ bằng các phương trình phản ứng hoàn chỉnh. Phản ứng nào là phản ứng oxi hóa khử? Nêu rõ chất khử và chất oxi hóa của mỗi phản ứng đó.
(b) Tính khối lượng dung dịch H2SO4 98% điều chế được từ 1 tấn quặng pirite sắt (có chứa 60% FeS2 về khối lượng). Biết hiệu suất cả quá trình là 80%.
(c) Đề xuất công thức cấu tạo phù hợp cho FeS2. Biết các nguyên tử S có số oxi hóa là –1.
Video giải chi tiết chỉ có trong khóa học online Học tốt Hóa 10
