Hóa học và phòng chống cháy nổ là một chuyên đề học tập thuộc chươn trình Hóa 10, bài viết được tổng hợp bởi Lê Hoàng Minh.
1. Các thảm họa cháy nổ đã xảy ra và hậu quả
Số liệu thống kê cho thấy, cứ sau mỗi tai nạn cháy nổ là hậu quả hết sức nặng nề và vô cùng thương tâm. Tuy nhiên nếu quan sát và phân tích số liệu, chúng ta có thể thấy rằng khi nền văn minh của con người càng phát triển thì hậu quả do tai nạn cháy nổ để lại càng có chiều hướng giảm. Dù thế nào đi chăng nữa, cứ mỗi khi có tai nạn cháy nổ xảy thì chắc chắn rằng những mất mát về tài sản và thậm chí là tính mạng là điều khó có thể tránh khỏi.
Hiểu được vấn đề đó cũng như ý thức được sự nguy hiểm của các tai nạn cháy nổ, nên tôi đã cố gắng tìm đọc và tổng hợp những kiến thức chung nhất về cháy nổ với mong muốn chung cấp cho mọi người một cái nhìn khoa học về sự cháy (hay phản ứng cháy) cũng như sự nổ. Qua đó, mỗi cá nhân sẽ có thêm kiến thức để có thể chủ động phòng ngừa cũng như xử lí khi có sự cố cháy nổ xảy ra.
2. Kiến thức cơ bản về cháy nổ
Sự cháy (phản ứng cháy) là một loại phản ứng oxy hóa khử, mà xảy ra giữa nhiên liệu với các chất oxy hóa (thường là oxygen), giải phóng năng lượng dưới dạng nhiệt và ánh sáng.
– Phản ứng cháy giữa hydrocarbon với oxygen:
– Methane bốc cháy khi có mặt khí fluor:
– Phản ứng cháy của magnesium và carbon dioxide:
– Phản ứng cháy giữa nhôm với oxygen:
Như vậy để sự cháy xảy ra cần ba yếu tố là nhiên liệu, chất oxi hóa và nguồn nhiệt, tuy nhiên khi có cả ba yếu tố thì sự cháy vẫn không xảy ra cho đến khi nguồn nhiệt phải đạt đến giới hạn bắt cháy của sự cháy, thời gian tiếp xác của ba yếu tố đủ dài và lượng oxi đủ nhiều (hơn 14%).
Theo nguyên tắc chung, đốt cháy các chất có chứa C sẽ tạo ra CO2 hoặc CO, chứa H sẽ tạo ra H2O, chứa S sẽ tạo ra SO2, … các sản phẩm sinh ra từ sự cháy gọi là những sản phẩm cháy. Hầu hết các sản phẩm cháy này đều gây hại cho con người.
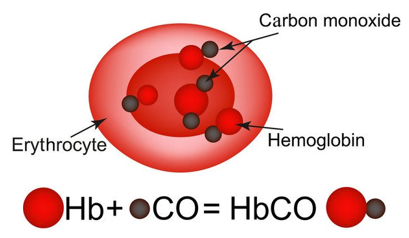
Oxygen được vận chuyển trong máu bởi hemoglobin. Tuy nhiên, carbon monoxide (CO) cũng liên kết với vị trí trên hemoglobin mà oxygen hoạt động. Khi CO liên kết với hemoglobin, chúng sẽ làm cho phân tử hemoglobin trở nên vô dụng trong việc vận chuyển oxygen. Nếu hít phải đủ khí CO, bạn sẽ chết vì ngạt thở. Do đó CO rất độc đối với con người, ở nồng độ 1,28%CO, con người bất tỉnh sau 2-3 hơi thở, chết ngạt sau 2-3 phút.
Điểm chớp cháy là nhiệt độ tối thiểu tại đó hơi có trong chất lỏng tạo thành hỗn hợp dễ cháy khi trộn với không khí (phân biệt với điểm sôi) ở áp suất khí quyển. Điểm chớp cháy cung cấp một chỉ số đơn giản và thuận tiện cho tính dễ cháy và bắt lửa của các chất. Theo hiệp hội phòng cháy chữa cháy Hoa Kỳ (NFPA), các điểm chớp cháy được phân nhóm từ 0 đến 4 theo nhiệt độ, như vậy chất loại 4 có điểm chớp cháy thấp nhất và dễ cháy nhất.
– Nhiệt độ bốc cháy: là nhiệt độ mà tại đó nhiên liệu được đốt nóng trong điều kiện theo tiêu chuẩn bị bắt cháy khi châm ngọn lửa vào và cháy không dưới 5 giây.
– Nhiệt độ tự bốc cháy: là nhiệt độ thấp nhất mà tại đó hỗn hợp hơi của nhiên liệu và không khí tự bốc cháy mà không cần có sự tiếp xúc của nguồn nhiệt tại điều kiện áp suất khí quyển.
Giả sử có một chất cháy ở trạng thái lỏng, ví dụ nhiên liệu Diesel, được đặt trong cốc bằng thép. Cốc được nung nóng với tốc độ nâng nhiệt độ xác định. Khi tăng dần nhiệt độ của nhiên liệu thì tốc độ bốc hơi của nó cũng tăng dần. Nếu đưa ngọn lửa trần đến miệng cốc thì ngọn lửa sẽ xuất hiện kèm theo tiếng nổ nhẹ, nhưng sau đó ngọn lửa lại tắt ngay. Vậy, nhiệt độ tối thiểu tại đó ngọn lửa xuất hiện khi tiếp xúc với ngọn lửa trần sau đó tắt ngay gọi là nhiệt độ chớp cháy của nhiên liệu.
Nếu tiếp tục nâng nhiệt độ của nhiên liệu cao hơn nhiệt độ chớp cháy thì sau khi đưa ngọn lửa trần tới miệng cốc quá trình cháy xuất hiện sau đó ngọn lửa vẫn tiếp tục cháy. Nhiệt độ tối thiểu tại đó ngọn lửa xuất hiện và không bị dập tắt gọi là nhiệt độ bốc cháy của nhiên liệu.
Nung nóng bình có chứa metan và không khí, từ từ ta sẽ thấy ở nhiệt độ nhất định thì hỗn hợp khí trong bình sẽ tự bốc cháy mà không cần có sự tiếp xúc với ngọn lửa trần. Vậy, nhiệt độ tối thiểu tại đó hỗn hợp khí tự bốc cháy không cần tiếp xúc với ngọn lửa trần gọi là nhiệt độ tự bốc cháy của nó.
Phản ứng nổ là phản ứng xảy ra với tốc độ nhanh kèm theo sự tăng thể tích đột ngột và tỏa nhiệt lượng lớn.
+ Nổ vật lý: là nổ do áp suất trong một thể tích tăng lên quá cao thể tích đó không chịu được áp lực lớn nên bị nổ. (nổ lốp xe, nổ nồi hơi, …)
+ Nổ hóa học: là hiện tượng cháy xảy ra với tốc độ nhanh làm hỗn hợp khí xung quanh giãn nở đột biến, sinh công gây nổ.
+ Nổ bụi: là quá trình bốc cháy nhanh của các hạt bụi mịn phân tán trong không khí.
Hóa học phản ứng đốt cháy nổ (với O2): liên kết đôi trong oxygen yếu hơn nhiều so với các liên kết đôi hoặc các cặp liên kết đơn khác (trong CO2 và H2O), do đó khi hình thành các liên kết bền hơn dẫn đến việc năng lượng được giải phóng (thường ở dạng nhiệt, hoặc làm tăng chuyển động nhiệt). Đây là lí do mà lửa nóng bất kể nhiên liệu là gì.
Trong trường hợp phản ứng cháy của methane nước ở trạng thái lỏng chúng ta cần đưa về thể khí trước khi tính ethalpy. Đối với nước, sự thay đổi entanpi của việc hóa hơi là +41 kJ mol -1. Điều đó có nghĩa là cần 41 kJ để biến 1 mol nước lỏng thành hơi nước. Nếu 1 mol hơi nước ngưng tụ thành nước, sự thay đổi entanpi sẽ là -41 kJ. Chuyển từ chất lỏng sang chất khí cần nhiệt; đổi chất khí thành chất lỏng giải phóng đúng một lượng nhiệt.
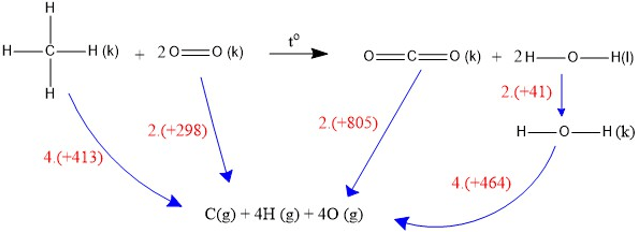
Vậy ΔH phản ứng = 4×413 + 2×498 – 2×805 – 2×41 – 4×464 = -900 kJ.mol-1
Nếu dấu của kết quả tính entanpy ΔH là dương, đây là phản ứng thu nhiệt. Ngược lại, nếu dấu của ΔH là âm thì đó là phản ứng tỏa nhiệt. Giá trị này càng lớn thì tính thu hoặc tỏa nhiệt của phản ứng càng lớn. Cần cẩn thận với các phản ứng tỏa nhiệt mạnh vì các phản ứng này có thể tỏa ra một nguồn năng lượng lớn và nếu phản ứng xảy ra nhanh, còn có thể gây nổ.
3. Các nguyên nhân gây ra cháy nổ phổ biến hện nay
Về cơ bản, nguyên nhân cháy nổ có thể chia thành hai nhóm chính: cháy nổ bắt nguồn từ các vật dụng gây cháy và cháy nổ bắt nguồn từ các phản ứng hóa học gây cháy.
Cháy nổ bắt nguồn từ các vật dụng gây cháy:
– Cháy nổ liên quan đến nấu nướng.
– Cháy nổ gây ra bởi các thiết bị tạo nhiệt.
– Cháy nổ do điện.
– Cháy nổ do hút thuốc.
– Cháy nổ do đốt nến vè diêm, …
Cháy nổ liên quan đến các phản ứng hóa học gây cháy:
– Cháy nổ do các hóa chất dễ cháy như gas, xăng, dầu, sơn, …
4. Các phương pháp phòng và chữa cháy, nổ hữu hiệu
Nguyên lý phòng cháy nổ là tách rời ba yếu tố: chất cháy, chất oxy hoá và mồi bắt lửa.
Nguyên lý chống cháy nổ là hạ thấp tốc độ cháy của vật liệu đang cháy đến mức tối thiểu và phân tán nhanh nhiệt lượng của đám cháy ra ngoài, ngăn cản sự tiếp xúc của đám cháy với oxygen.
4.1. Ngăn cách oxygen với chất cháy (cách ly)
Cách ly oxygen với chất cháy hoặc tách rời chất cháy ra khỏi vùng cháy. Dùng thiết bị chất chữa cháy úp, chụp, đậy, phủ lên bề mặt của chất cháy. Ngăn chặn oxygen trong không khí tiếp xúc với vật cháy, đồng thời di chuyển vật cháy ra khỏi vùng cháy. Các thiết bị chất chữa có tác dụng cách ly như lắp đậy chậu, đất cát, bọt chữa cháy, chăn nệm, bao tải, vải bạt.
4.2. Làm loãng nồng độ oxygen và hỗn hợp chất cháy (làm ngạt)
Dùng các chất không tham gia phản ứng cháy phun vào vùng cháy làm loãng nồng độ oxygen và hỗn hợp cháy tới mức bị ngạt không duy trì được sự cháy. Sử dụng các chất chữa cháy như khí CO2, nitrogen (N2) bọt trơ.
Dùng các chất chữ cháy có khả năng thu nhiệt làm giảm nhiệt độ của đám cháy nhỏ hơn nhiệt độ bắt cháy của chất cháy đám cháy sẽ tắt. Sử dụng các chất chữa cháy như khí trơ lạnh CO2, N2, H2. Sử dụng nước chữa cháy cần chú ý không dùng nước chữa các đám cháy đang có điện, hóa chất kỵ nước như: xăng, dầu, gas và đám cháy có nhiệt độ cao trên 1900 °C mà nước quá ít.
