Bromine (Br), nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn, ở điều kiện thường nó tồn tại dạng phân tử Br2, là chất lỏng có màu đỏ đậm, dễ dàng bay hơi ở nhiệt độ thường, nếu hít phải lượng lớn có thể dẫn đến tử vong.
1. Sơ lược về bromine
Do đặc tính trên, Br2 thường được sử dụng trong các hệ kín, sử dụng “in situ” (ngay tại chỗ, vừa được tạo ra) trong lòng dung dịch phản ứng, lưu trữ Br2 thường sử dụng bình trung tính, ống thủy tinh kín đầu sậm màu tránh sự phân hủy bới ánh sáng môi trường và sử dụng dung môi hòa tan tốt Br2 như các dung môi hữu cơ hoặc nước để tránh hiện tượng bay hơi.
| Khối lượng nguyên tử | 79.901−79.907 |
| Nhiệt độ nóng chảy | −7.2 ºC |
| Nhiệt độ sôi | 59 ºC |
| Các trạng thái oxy hóa | −1, +1, +3, +5, +7 |
| Cấu hình electron | [Ar]3d104s24p5 |
Bromine được nhà hóa học người Pháp Antoine-Jérôme Balard phát hiện vào năm 1826 trong cặn bã chất thải từ quá trình sản xuất muối biển tại Montpellier. Ông giải phóng nguyên tố này bằng cách cho clorine đi qua dung dịch nước dư có chứa magiesium bromide. Chưng cất dung dịch trên với manganese dioxide và sulfuric acid tạo ra hơi màu đỏ, hơi nước ngưng tụ trên thành ống chuyển thành chất lỏng sẫm màu.
Dựa trên các hiện tượng tương tự như quy trình tạo ra khí Cl2 đã mách bảo cho Balard rằng ông đã thu được một nguyên tố mới tương tự như clo. (Trước đó, nhà hóa học người Đức Justus von Liebig dường như đã thu được nguyên tố này trước Balard, nhưng ông ta đã nhầm lẫn nó là iodine monochloride (ICl). Do mùi hôi của nguyên tố này, Viện Hàn lâm Khoa học Pháp đã gợi ý tên gọi brom là từ tiếng Hy Lạp, từ đó bromos ra đời, có nghĩa là “mùi hôi” hoặc “mùi hôi thối.”

Bromine có thể được tìm thấy trong tự nhiên, nó phân tán khắp lớp vỏ trái đất dưới dạng hợp chất với các nguyên tử khác, nguồn cung cấp bromine được cho chủ yếu từ muối biển, ở biển chết (trong 1 L nước biển chứa 5g muối chứa bromide). Trong các quặng khoáng sản một lượng nhỏ AgBr (kết tủa đen) cũng được tìm thấy, theo thống kê thì đầu thế kỷ 21, Trung Quốc và Hoa Kỳ dẫn đầu trong việc sản xuất Br2 từ các nguồn trong tự nhiên. Cũng như các nguyên tố khác bromine tồn tại hỗn hợp của các đồng vị bền: Br-79 (50.54%), Br-81 (49,46%).
Để tạo ra hỗn hợp Br2/H2O tiến hành trộn 3.41 g Br2 và 100 mL H2O cho đến khi hỗn hợp đồng nhất. Đặc biệt nên lưu trữ hỗn hợp Br2/H2O trong các vật chứa sậm màu tránh ánh sáng mặt trời.
H2O + Br2 → 2HBr + ½O2
Phản ứng phân hủy của Br2 trong nước với ánh sáng
Có thể chiết xuất gần như hoàn toàn Br2 từ nước bằng các dung môi hữu cơ kém phân cực như carbon tetrachloride (CCl4), carbon disulfide (CS2), … Khi Br2 tồn tại trong dung môi hữu cơ, hỗn hợp thường có màu cam.
2. Các phản ứng quan trọng của bromine
2.1. Phản ứng cộng electrophile của bromine vào alkene
Phản ứng cộng Br2 vào alkene là một phản ứng rất đặc biệt do sản phẩm của phản ứng này được sử dụng cho rất nhiều mục đích trong nghiên cứu cũng như ứng dụng trong đời sống. Sản phẩm chứa 2 nhóm bromo được sử dụng để tổng hợp alkyne, chúng thường được sử dụng như một hóa chất nền tảng trong các phản ứng thế thân hạch bằng các tác nhân nucleophiles.
Sản phẩm chứa nhóm bromo và hydroxyl thường được nghiên cứu trong các phản ứng thân hạch thông qua hiệu ứng nhóm kề hay sử dụng trong tổng hợp epoxide ứng dụng trong tổng hợp polymer (epoxy) hay sử dụng trong khử khuẩn dụng cụ y tế như ethylene oxide.
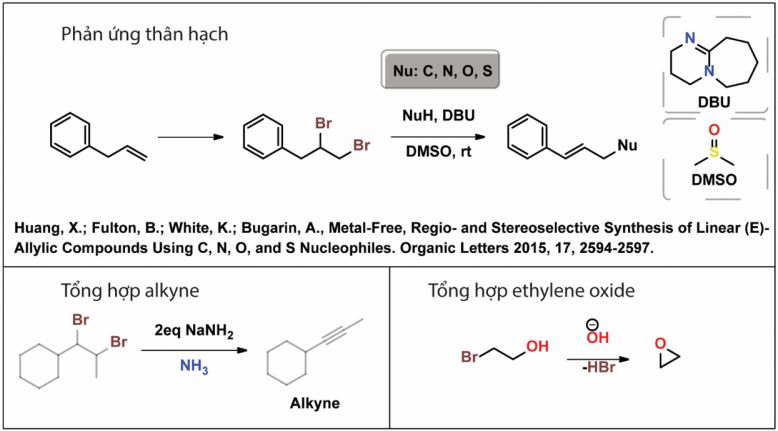
Trong điều kiện nhiệt độ thấp, alkene thực hiện phản ứng cộng với Br2 nguyên chất hoặc Br2 trong dung môi hữu cơ như tetrachloromethane cho ra sản phẩm cộng 1,2-dibromo. Phản ứng này thường được sử dụng như là một phương pháp nhận diện nối đôi cổ điễn, khi phản ứng xảy ra dung dịch chứa Br2 sẽ dần dần mất màu đỏ sẫm chuyển thành chất lỏng không màu. Trong trường hợp, sử dụng dung dịch nước Br2 sẽ có thêm sự tạo thành sản phẩm 1-ol-2-bromo.
Cơ chế của phản ứng:
B1: Tạo thành trung gian bromonium ion.
B2: Anion bromide hoặc nước tác kích phía ngược lại theo cơ chế SN2.
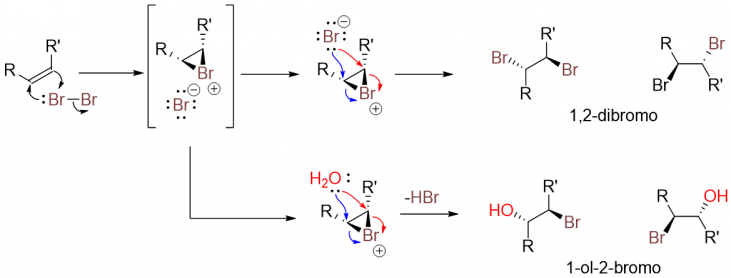
Nếu quan tâm về lập thể của phản ứng này thì do phản ứng đi theo cơ chế SN2, do đó chúng sản phẩm có chứa tâm lập thể, sản phẩm sinh ra có 2 nhóm thế nằm ngược phía với nhau (lập thể của phản ứng nếu có cơ hội mình sẽ chia sẽ thêm ở các bài viết khác). Để đơn giản hóa vấn đề thì phản ứng alkene với dung dịch chứa Br2 về cơ bản sẽ sinh ra sản phẩm cộng thêm một phân tử brom vào phân tử chất nền, còn trường hợp có H2O sẽ sinh ra thêm sản phẩm chứa nhóm bromo và một nhóm hydroxyl.
2.2. Phản ứng của bromine với aniline và phenol
Nhóm -NH2 và nhóm -OH là hai ví dụ điển hình của nhóm tăng hoạt vòng benzene khiến cho các phản ứng thế electrophile lên vòng trở nên mạnh mẽ hơn rất nhiều, các phản ứng xảy ra rất khó dừng lại ở phản ứng thế một lần thay vào đó phản ứng sẽ diễn ra đến khi tất cả vị trí tăng hoạt trên vòng benzene đã được thế.
Các vị trí thế lên nhân thơm chịu ảnh hưởng bởi hai yếu tố chính đó là hiệu ứng liên hợp và hiệu ứng cảm, do các định hướng này khiến cho các phản ứng thế xảy ra tại các vị trí nhất định trên vòng thơm. Thông thường, vị trí thế sẽ chịu ảnh hưởng bởi hiệu ứng liên hợp mạnh hơn so với hiệu ứng cảm và đặc biệt hiệu ứng liên hợp cũng là lý do chính dẫn tới cấu trúc điện tử bất định xứ của vòng benzene khiến cho chúng ta hiện tại có 2 cách vẽ mô tả vòng benzene như sau.

Ở các điều kiện phản ứng thông thường có thể sắp xếp đơn giản khả năng phản ứng thế như sau: aniline, phenol > toluene > benzene > chlorobenzene > nitrobenzene. (Ở các bài viết khác mình sẽ giới thiệu rõ hơn về các hiệu ứng điện tử và quy tắc định hướng trên vòng benzene cho các bạn)
Phản ứng thế bromine của aniline và phenol diễn ra rất nhanh và mãnh liệt do đó phản ứng này còn được sử dụng trong phản ứng định danh vòng hương phương tăng hoạt. Trên thực tế hầu như không có hiệu suất 100% cho một sản phẩm nào cả, mà các phản ứng thế thường sẽ tồn tại rất nhiều loại sản phẩm tuy nhiên trong trường hợp này: tỷ lệ sản phẩm thế ortho, para và thế ba nhóm bromo lên vòng thơm tăng hoạt chiếm phần lớn tỷ lệ sản phẩm.
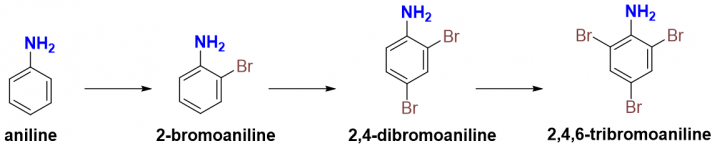
Đối với Br2 tinh khiết hay trong các dung môi khác thì phản ứng vẫn diễn ra với việc thế 3 nhóm bromo lên vòng benzene, phản ứng khiến cho màu của dung dịch Br2 nhạt màu và xuất hiện kết tủa trắng (dẫn xuất 2,4,6-tribromo).
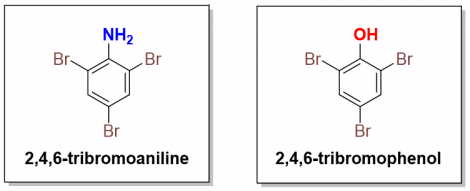
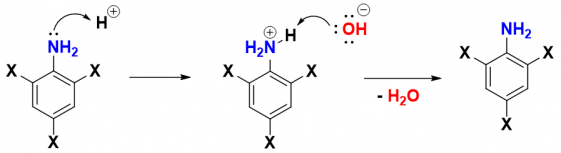
Do cả hai hợp chất đều cho kết tủa trắng và làm mất màu dung dịch Br2 nên do đó chúng ta có thể thực hiện thêm một phản ứng đơn giản khác để tách chúng ra khỏi nhau dựa trên nguyên tắc các hợp phần phân cực sẽ tan tốt trong nước hơn so với phân tử hữu cơ:
B1: Chuẩn bị 2 ống dung dịch (1 ống dung dịch HCl, 1 ống dung dịch NaOH có tỷ lệ mol tương đương với lượng sản phẩm muốn tách).
B2: Cho vào hỗn hợp dung dịch NaOH, lắc đều nhận thấy các dẫn xuất của phenol tan vào nước (do các dẫn xuất của phenol mang tính acid nên H linh động trên nhóm -OH sẽ thực hiện phản ứng acid base tạo thành muối -ONa phân cực tan tốt vào nước).
B3: Tách lọc lấy phần dung dịch và phần chất rắn (dẫn xuất của aniline), acid hóa phần dung dịch bằng ống dung dịch HCl có tỷ lệ mol tương đương, thu được phần chất rắn (dẫn xuất của phenol).

Quy tắc này có thể thực hiện ngược lại bằng cách acid hóa trước sau đó sử dụng base trung hòa, B2 sẽ thu được dẫn xuất phenol trước và B3 sẽ thu được lại dẫn xuất aniline lý do ở đây là do đôi điện tử trên aniline có thể nhận H+ như một base lewis khiến cho nhóm -NH2 chuyển thành nhóm -NH3+ phân cực tan tốt trong nước.
2.3. Phản ứng nước bromine oxy hóa aldehyde
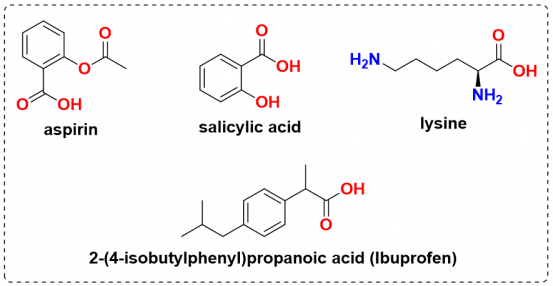
Acid carboxylic là một hợp chất rất quan trọng trong tổng hợp hữu cơ, rất nhiều hợp chất có hoạt tính sinh học mang nhóm chức này có thể kể đến như: aspirin (hạ sốt, giảm đau), salicylic acid (giảm mụn), ibuprofen (chống viêm), lysine (amino acid quan trọng, thiếu lysine có thể dẫn đến bệnh chậm phát triển)…
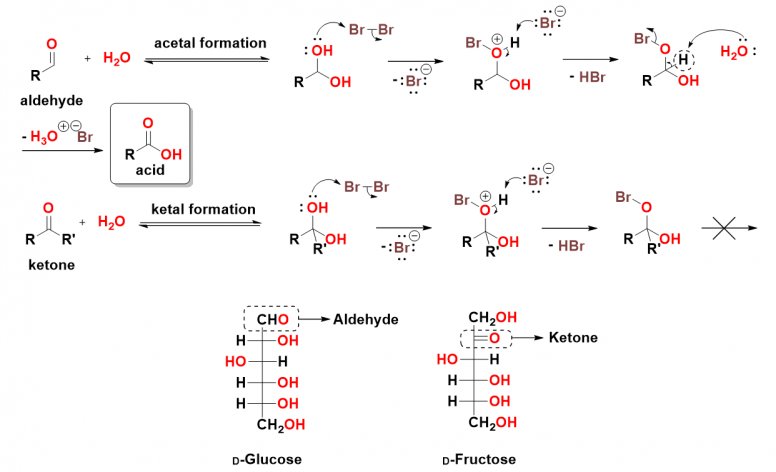
Do đó các phản ứng chuyển hóa nhóm aldehyde thành carboxylic được quan tâm nghiên cứu rất nhiều, Br2/H2O là một hệ thống oxi hóa hiệu quả, có độ chọn lọc tốt. Nó được sử dụng phổ biến như một loại thuốc thử, giúp oxi hóa aldehyde thành acid carboxylic và phản ứng rất chọn lọc khi nó không xảy ra trên alcohol, ketone tương tự, thường được sử dụng nhận biết giữa glucose, fructose thông qua sự mất màu của dung dịch Br2.
Lý do có độ chọn lọc trên đó là do ketone không còn chứa proton nào để tách loại để loại bỏ ion bromide như trường hợp aldehyde. Để hiểu rõ hơn chúng ta có thể quan sát cơ chế phản ứng dưới đây:
3. Tóm tắt các phản ứng của bromine
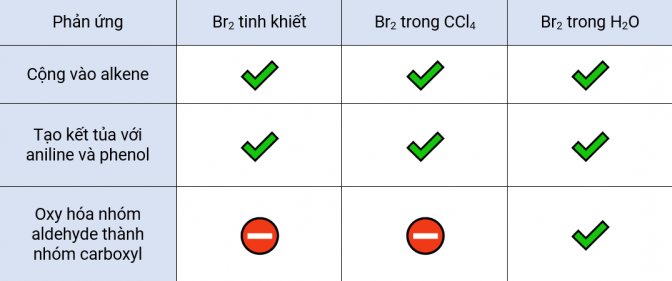
Bài viết đã giới thiệu sơ lược về lịch sử, các phương pháp lưu trữ, … của bromine và các phản ứng của nó trong điều kiện khác nhau như không dung môi, dung môi nước, dung môi hữu cơ CCl4 và một số ứng dụng trong tổng hợp cũng như ứng dụng của một số hợp chất trong đời sống. Hiện tại, các phản ứng trên vẫn luôn được nghiên cứu và phát triển cái mới tuy nhiên các phản ứng sử dụng trên bài vẫn là một phương pháp hữu hiệu giúp định danh một số hợp chất bằng các quan sát rất trực quan như mất màu dung dịch, xuất hiện kết tủa.
