Bài giảng Mô hình nguyên tử Bohr
Mô hình nguyên tử Bohr là bài giảng số 4 của chủ đề Nguyên tử và bảng tuần hoàn – Hóa đại cương 1 của Hóa ĐH, ngay sau bài 3 – Nguyên tố và đồng vị.
Trước tiên cần ôn tập lại về sóng điện từ và quang phổ phát xạ của nguyên tử. Sóng điện từ tồn tại khắp nơi, một số ít có thể nhìn thấy bằng mắt thường, còn phần lớn thì không. Ánh sáng từ mặt trời, năng lượng từ lò vi sóng, tia X trong công nghệ chụp X quang, sóng radio để liên lạc, … tất cả đều là sóng điện từ.
1. Sơ lược về sóng điện từ
Tất cả sóng điện từ đều có đặc điểm chung là mang năng lượng và truyền đi dưới dạng sóng với tốc độ truyền trong chân không bằng với tốc độ ánh sáng (c = 2.9979 × 108 m·s–1).
Bốn đặc trưng cơ bản của sóng điện từ gồm tốc độ truyền, bước sóng, tần số và cường độ. Bước sóng (ký hiệu λ) là khoảng cách giữa hai đỉnh sóng kế cận. Tần số (ký hiệu υ) là số chu kỳ sóng đi qua một điểm nào đó trong một giây. Hình bên có λ1 > λ2 > λ3 nên trong cùng đơn vị thời gian, tần số của sóng đầu tiên nhỏ nhất, tần số của sóng thứ hai lớn hơn và tần số của sóng cuối lớn nhất. Như vậy, sóng có bước sóng ngắn sẽ mang năng lượng cao và ngược lại, sóng có bước sóng dài sẽ mang năng lượng thấp.
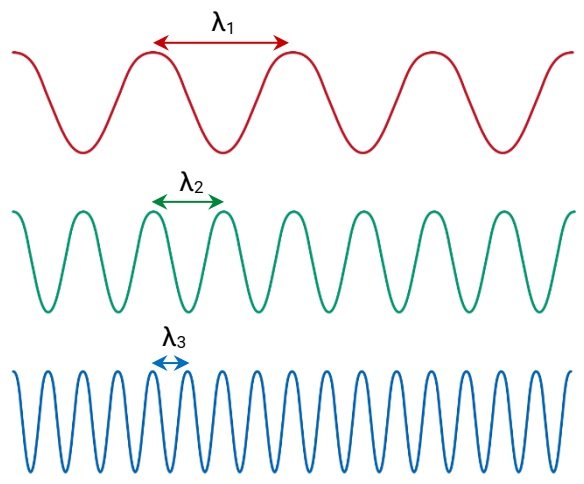
Tương quan giữa bước sóng và tần số được biểu diễn qua công thức:
c = λυ
Bước sóng được tính bằng m nên tần số có đơn vị là s–1 hay Hz.
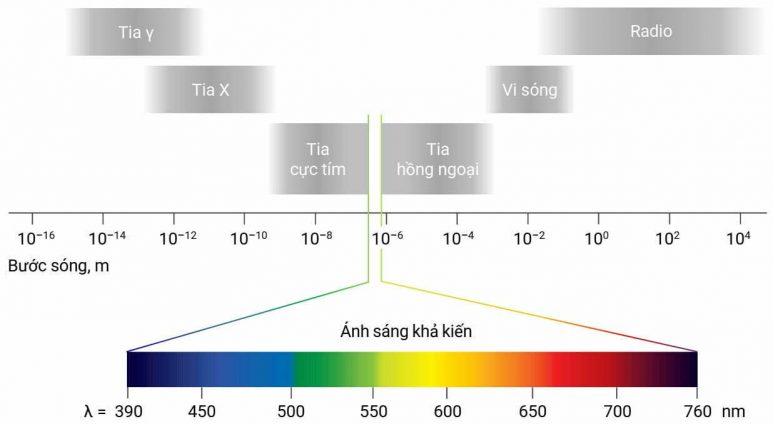
Hình trên là các dạng sóng điện từ khác nhau được sắp xếp theo chiều tăng dần bước sóng. Mắt người chỉ có thể nhìn thấy vùng sóng từ 390 nm đến 760 nm, gọi là vùng ánh sáng khả kiến, dưới hoặc trên mức này đều không nhìn thấy được. Tia γ và tia X có khả năng đâm xuyên mạnh, ngược lại, vi sóng và radio có khả năng đâm xuyên yếu.
2. Quang phổ phát xạ của nguyên tử
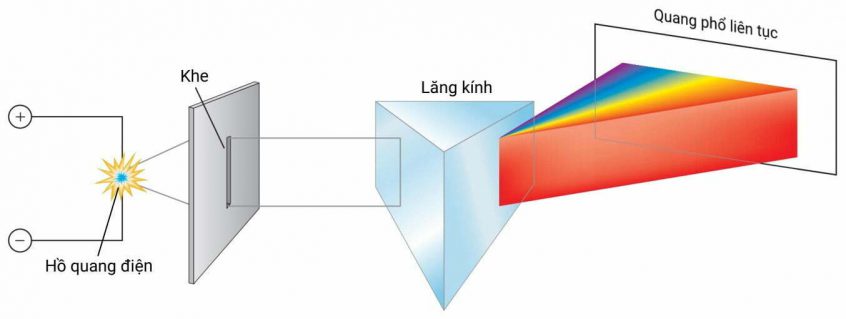
Ánh sáng trắng khi đưa qua lăng kính sẽ cho hiện tượng tán sắc, từ màu trắng phân ra thành một dải nhiều màu như cầu vồng, dải màu đó gọi là quang phổ liên tục. Tương tự, khi nung nóng một vật rắn thì nó cũng phát ra quang phổ liên tục.
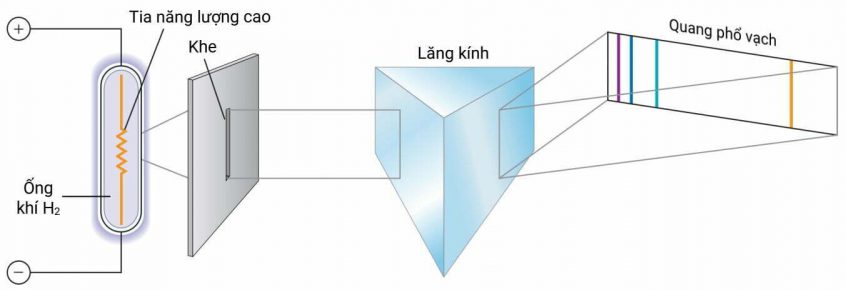
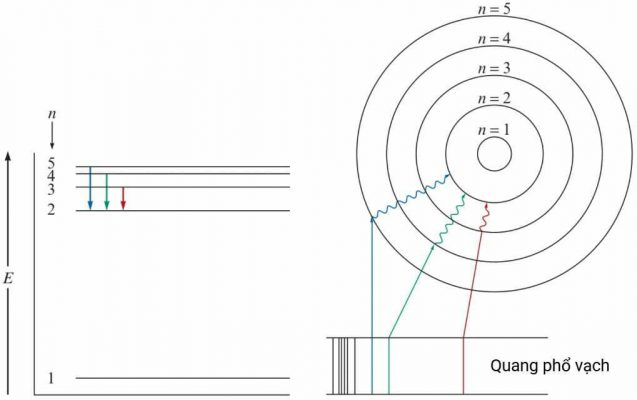
Khi phóng dòng điện qua khí hydrogen thì thu được các bức xạ có bước sóng rời rạc, gọi là quang phổ vạch phát xạ của nguyên tử hydrogen. Hiện tượng này là do các phân tử H2 hấp thu năng lượng lớn làm đứt liên kết H–H, tạo ra nguyên tử H ở trạng thái kích thích. Các nguyên tử đang được kích thích này giải phóng năng lượng dưới dạng các photon để về trạng thái ổn định.
Những loại nguyên tử khác nhau thì tạo ra những quang phổ vạch khác nhau và đặc trưng cho từng nguyên tố, giống như dấu vân tay của mỗi người đều khác nhau. Đây là công cụ đắc lực giúp các nhà khoa học nhận biết những nguyên tố mới.
3. Mô hình nguyên tử Bohr
Năm 1913, từ mô hình nguyên tử Rutherford, Niels Bohr kết hợp vật lý cổ điển với khái niệm năng lượng lượng tử của Planck để đưa ra mô hình mới nhằm giải thích cho hiện tượng trên.
Các điểm chính trong mô hình nguyên tử Bohr là:
-
Trong nguyên tử hydrogen, electron chỉ chuyển động trên một số quỹ đạo tròn nhất định, được gọi là các quỹ đạo trạng thái dừng, gọi tắt là quỹ đạo dừng.
-
Khi đang ở một quỹ đạo dừng nào đó, electron có năng lượng xác định, gọi là năng lượng trạng thái dừng. Nói cách khác, nguyên tử không hấp thu hoặc phát xạ năng lượng khi electron chuyển động trên một quỹ đạo dừng. Để có được tính chất đặc biệt này, Bohr cho rằng electron trên mỗi quỹ đạo dừng có một giá trị moment góc không đổi, bằng nh/2π.
-
Nguyên tử chỉ hấp thu hay phát xạ năng lượng khi electron chuyển từ quỹ đạo dừng này sang quỹ đạo dừng khác.
Chuyển động của electron trên các quỹ đạo này tuân theo các định luật vật lý cổ điển:
– Lực hút tĩnh điện của hạt nhân phải cân bằng với lực ly tâm nên có công thức:
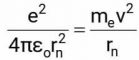
– Năng lượng của electron lúc này bằng tổng động năng và thế năng:
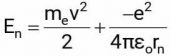
– Một vật chuyển động tròn thì có moment góc là mevrn nên:
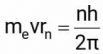
Từ ba phương trình trên suy ra được hai công thức quan trọng về bán kính và năng lượng của nguyên tử hydrogen với electron chuyển động ở các quỹ đạo khác nhau:
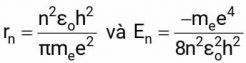
Trong đó:
- n là số nguyên tự nhiên ứng với thứ tự của quỹ đạo dừng từ trong ra ngoài.
- me là khối lượng của electron, me = 9.109 × 10–31 kg.
- e là điện tích nguyên tố, e = 1.602 × 10–19 C.
- εo là hằng số điện môi của chân không, εo = 8.8543 × 10–12 C2·m–1·J–1.
- h là hằng số Planck, h = 6.626 × 10–34 J·s.
Thay các số liệu vào ta được:

Trạng thái bền nhất của nguyên tử hydrogen là khi nó có năng lượng thấp nhất, nghĩa là electron đang ở quỹ đạo dừng thứ nhất (n = 1), còn gọi là trạng thái cơ bản. Khi nguyên tử hydrogen nhận năng lượng sẽ chuyển dần ra các quỹ đạo dừng khác có năng lượng cao hơn (n > 1) gọi là trạng thái kích thích. Trạng thái kích thích không bền nên nguyên tử ở trạng thái này có xu hướng chuyển về trạng thái có năng lượng thấp hơn hoặc về hẳn trạng thái cơ bản, kèm với sự phát ra năng lượng. Gọi nt và ns là thứ tự trước và sau, ta có:
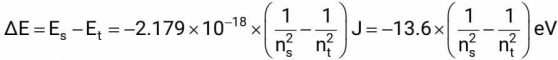
Từ ΔE có thể tính được tần số hoặc bước sóng của photon hấp thu hay phát xạ tương ứng:
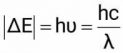
Vì các giá trị của n là số nguyên nên bức xạ thu được có tính gián đoạn, điều này giải thích được hiện tượng quang phổ vạch của nguyên tử hydrogen và các nguyên tử nguyên tố khác.
4. Năng lượng ion hóa của nguyên tử hydrogen
Từ ý tưởng trên ta có thể tính được năng lượng ion hóa của nguyên tử hydrogen, năng lượng cần để giải phóng một electron ra khỏi nguyên tử hydrogen, chuyển nguyên tử H thành ion H+. Xem electron tự do, đã thoát ra khỏi nguyên tử là khi nó ở rất xa hạt nhân đến vô cùng (n = ∞).
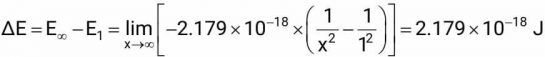
Giá trị này đúng với giá trị đo được từ thực nghiệm.
5. Áp dụng vào các ion có một electron
Mô hình nguyên tử Bohr có thể áp dụng cho các ion có một electron khác như He+ và Li2+. Chỉ cần thay điện tích hạt nhân Z vào công thức của nguyên tử hydrogen ta được:
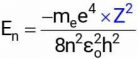
Tuy nhiên khi áp dụng vào các nguyên tử có nhiều electron khác thì mô hình này không cho kết quả đúng với thực nghiệm. Ngay cả khi thay quỹ đạo tròn bằng quỹ đạo ellipse cũng không thu được kết quả hứa hẹn. Nguyên nhân là do Bohr đã kết hợp vật lý cổ điển và hiện đại mà không dựa trên một cơ sở khoa học nào, không bao gồm lực đẩy giữa các electron và nhiều yếu tố khác.
Sau này thuyết cơ học lượng tử đã thay thế cho mô hình nguyên tử Bohr. Theo thuyết cơ học lượng tử, chuyển động của electron trong nguyên tử mang tính sóng, khác với chuyển động theo quỹ đạo tròn.
Luyện tập Mô hình nguyên tử Bohr
Phần lớn ánh sáng từ đèn hơi sodium có bước sóng là 589 nm. Tần số của bức xạ này là bao nhiêu?
υ = c/λ = (2.9979 × 108) / (589 × 10–9) = 5.09 × 1014 Hz.
Một đài phát thanh FM phát trên tần số 91.5 megahertz (MHz). Bước sóng của các sóng radio này tính bằng m là bao nhiêu?
λ = c/υ = (2.9979 × 108) / (91.5 × 106) = 3.28 m.
Đối với bức xạ có bước sóng 242.4 nm, bước sóng dài nhất gây ra hiện tượng phân ly O2. Năng lượng của (a) một photon và (b) một mol photon của bức xạ này là bao nhiêu?
(a) E = hc/λ = (6.626 × 10–34 × 2.9979 × 108) / (242.4 × 10–9) = 8.195 × 10–19 J·photon–1.
(b) E = 6.022 × 1023 × 8.195 × 10–19 = 4.935 × 105 J·mol–1.
Khả năng bảo vệ của tầng ozone trong khí quyển là do các phân tử ozone hấp thụ bức xạ UV trong dải bước sóng từ 230 đến 290 nm. Năng lượng tính bằng kJ·mol–1, liên quan đến bức xạ trong dải bước sóng này là bao nhiêu?
E = NA × hc/λ = 6.022 × 1023 × (6.626 × 10–34 × 2.9979 × 108) / (230 × 10–9)
= 5.20 × 105 J·mol–1 = 520 kJ·mol–1.
Tính tương tự với λ = 290 nm ⟹ E = 412 kJ·mol–1.
Dải bước sóng trên có năng lượng từ 412 đến 520 kJ·mol–1.
Chlorophyll hấp thụ ánh sáng với năng lượng là 3.056 × 10–19 và 4.414 × 10–19 J·photon–1. Sự hấp thụ này tương ứng với màu sắc và tần số nào?
λ = hc/E = (6.626 × 10–34 × 2.9979 × 108) / (3.056 × 10–19) = 6.50 × 10–7 m = 650 nm.
Tính tương tự với E = 4.414 × 10–19 J ⟹ λ = 450 nm.
Bước sóng 650 nm tương ứng với ánh sáng đỏ, còn 450 nm tương ứng với ánh sáng chàm.
Có nguyên tử hydrogen nào có electron ở mức năng lượng E = –1.00 × 10–20 J hay không?
Thay vào phương trình En = –2.179 × 10–18 / n2 ⟹ n = 14.76, đây không phải là số nguyên nên không tồn tại nguyên tử hydrogen nào có electron ở mức năng lượng E = –1.00 × 10–20 J.
Có nguyên tử hydrogen nào có electron ở mức năng lượng E = –2.69 × 10–20 J hay không?
Thay vào phương trình En = –2.179 × 10–18 / n2 ⟹ n = 9.00 là số nguyên nên có tồn tại nguyên tử hydrogen có electron ở mức năng lượng E = –2.69 × 10–20 J (quỹ đạo dừng thứ 9).
Xác định bước sóng của bức xạ được hấp thụ để dịch chuyển electron từ n = 2 đến n = 4 trong nguyên tử hydrogen.
ΔE = E4 – E2 = –2.179 × 10–18 × (1/42 – 1/22) = 4.086 × 10–19 J.
λ = hc/ΔE = 4.861 × 10–7 m = 486.1 nm.
Xác định động năng của electron bị ion hóa từ ion Li2+ ở trạng thái cơ bản, sử dụng một photon có tần số là 5.000 × 10–16 s–1.
Năng lượng của electron: E = Z2 × E1 = 32 × –2.179 × 10–18 = –1.961 × 10–17 J.
Năng lượng ion hóa chính là năng lượng cần để tách electron trong Li2+ ra, chỉ còn lại hạt nhân, năng lượng này đúng bằng |E|: Eion hóa = –E = 1.961 × 10–17 J.
Năng lượng của photon: Ephoton = hυ = 6.626 × 10–34 × 5.000 × 1016 = 3.313 × 10–17 J.
Khi nhận năng lượng từ photon, electron văng ra, phần năng lượng còn dư ra chính là động năng của electron ⟹ Động năng = Ephoton – Eion hóa = 3.313 × 10–17 – 1.961 × 10–17 = 1.352 × 10–17 J.
Tần số của quá trình chuyển electron từ n = 3 đến n = 2 đối với một ion giống hydrogen (chỉ có một electron) gấp 16 lần tần số của nguyên tử hydrogen. Ion này là gì?
Năng lượng chuyển electron từ n = 3 đến n = 2 trong hydrogen là: ΔEH = E2 – E3.
Năng lượng chuyển electron từ n = 3 đến n = 2 trong nguyên tử số hiệu Z là: ΔEZ = Z2 × (E2 – E3).
ΔE tỉ lệ thuận với υ ⟹ υ gấp 16 lần nên Z2 = 16 ⟹ Z = 4 ⟹ Đây là ion Be3+.
