Cấu tạo nguyên tử là bài giảng thứ hai của chủ đề Nguyên tử và bảng tuần hoàn – Hóa đại cương 1 của Hóa ĐH, ngay sau bài 1 – Học thuyết nguyên tử.
Điện và từ đã được sử dụng trong các thí nghiệm dẫn đến lý thuyết hiện tại về cấu tạo nguyên tử. Một số vật hiển thị một thuộc tính gọi là điện tích, có thể là dương (+) hoặc âm (–). Các điện tích dương và âm hút nhau, còn hai điện tích dương hoặc hai điện tích âm đẩy nhau. Tất cả các đối tượng của vật chất đều được tạo thành từ các hạt mang điện.
Những vật có số điện tích dương và số điện tích âm bằng nhau thì trung hòa về điện. Nếu số điện tích dương vượt quá số điện tích âm thì vật có điện tích thuần dương. Nếu số điện tích âm vượt quá số điện tích dương thì vật có điện tích thuần âm. Khi một điện tích dương tích tụ ở một nơi, thì một điện tích âm có kích thước bằng với nó sẽ xuất hiện ở một nơi khác sao cho điện tích được cân bằng.
1. Sự khám phá ra electron (cấu tạo nguyên tử bên ngoài)
Trước khi có màn hình tinh thể lỏng (LCD, liquid crystal display), ống tia âm cực (CRT, cathode–ray tube) là trái tim của màn hình máy tính và TV. Ống tia âm cực đầu tiên được chế tạo bởi Michael Faraday khoảng 150 năm trước. Khi truyền dòng điện qua ống thủy tinh bên trong phần lớn không khí đã được hút hết, ông đã phát hiện ra tia âm cực, một loại bức xạ do cực âm phát ra. Bức xạ đi qua ống chân không đến cực dương.
Các nhà khoa học phát hiện ra tia này truyền theo đường thẳng và có nhiều đặc tính không phụ thuộc vào chất liệu cathode. Cấu tạo của CRT được thể hiện trong hình sau:
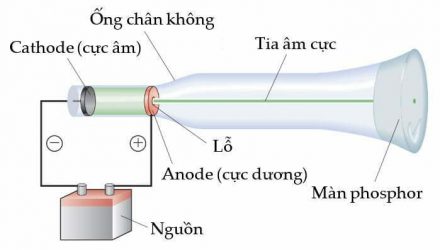
Các tia âm cực không thể nhìn thấy được bằng mắt thường và chỉ bị phát hiện bằng ánh sáng phát ra từ các vật liệu chúng chiếu vào. Vật liệu này được gọi là màn phosphor, được sơn trên phần cuối của CRT để phát hiện đường đi của tia âm cực (chúng phát ra ánh sáng khi bị tác động bởi bức xạ năng lượng). Một quan sát quan trọng khác về tia âm cực là chúng bị lệch hướng bởi điện trường và từ trường theo hướng giống với các hạt mang điện tích âm như hình dưới đây:
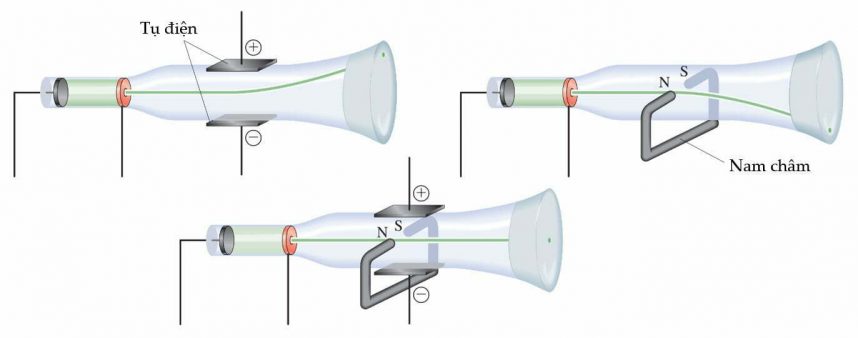
Chùm tia âm cực đập vào màn ở hình cuối không bị lệch hướng nếu lực tác dụng lên nó cân bằng. Từ mô hình trên, bằng cách biết cường độ điện trường và từ trường, cùng với các dữ liệu khác, có thể tính được tỷ lệ khối lượng trên điện tích (m/e).
Năm 1897, bằng cách trên, Joseph John Thomson đã tính chính xác được m/e = 5.6857×10–9 g/C. Ngoài ra, ông còn kết luận tia âm cực gồm các hạt cơ bản tích điện âm, có trong tất cả các nguyên tử. Các hạt này sau đó được gọi là electron, thuật ngữ do George Stoney đề xuất vào năm 1874.
Robert Millikan đã xác định điện tích e thông qua một loạt các thí nghiệm về giọt dầu được mô tả trong hình dưới đây. Các ion (nguyên tử hoặc phân tử tích điện) được tạo ra bởi bức xạ năng lượng, chẳng hạn như tia X. Một số ion trong số này gắn vào các giọt dầu, tạo cho chúng một điện tích thực. Sự rơi của các giọt này trong điện trường giữa các bản tụ tích điện được tăng tốc hay chậm lại do dấu của điện tích và độ lớn của nó.
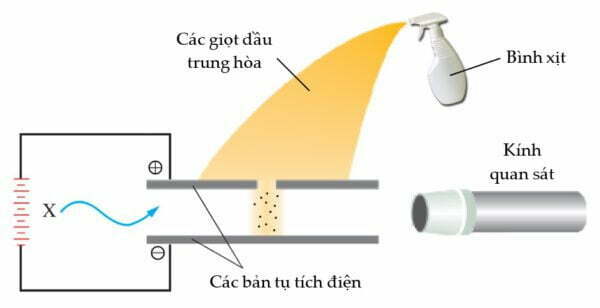
Bằng cách phân tích dữ liệu từ lượng lớn các giọt này (từ năm 1906 đến năm 1914), ông rút ra kết luận độ lớn điện tích trên chúng là bội số điện tích của một electron, ký hiệu của điện tích cơ bản là e (trị tuyệt đối điện tích của một electron). Giá trị được chấp nhận đến hiện tại là e = 1.6022×10–19 C. Kết hợp giá trị này với tỷ lệ khối lượng trên điện tích m/e, có thể tính được khối lượng của một electron là 9.1094×10–28 g. Như vậy electron là hạt hạ nguyên tử đầu tiên được xác định, mở đầu cho khoảng 100 năm đi tìm cấu tạo nguyên tử.
Khi electron được xem là hạt vật chất cơ bản có thể được tìm thấy trong tất cả nguyên tử, các nhà vật lý nguyên tử đã đề xuất cách mô hình mà các hạt này kết hợp tạo thành nguyên tử. Mô hình được chấp nhận phổ biến lúc này là của Thomson.
Ông cho rằng phải có điện tích dương trong nguyên tử làm đối trọng với điện tích âm của các electron, tạo ra các nguyên tử trung hòa. Ông cho rằng electron lơ lửng trong một đám mây khuếch tán điện tích dương. Mô hình cấu tạo nguyên tử này được gọi là mô hình bánh pudding mận (một món tráng miệng phổ biến ở Anh).

2. Tia X và sự phóng xạ (công cụ nghiên cứu cấu tạo nguyên tử)
Năm 1895, Wilhelm Röntgen thấy khi ống tia âm cực hoạt động, một số vật liệu bên ngoài phát huỳnh quang. Ông đã kết luận sự phát huỳnh quang này là do bức xạ của ống tia âm cực. Do chưa hiểu rõ bản chất của bức xạ này, Röntgen đặt ra thuật ngữ tia X.
Henri Becquerel cho rằng các chất khác cũng phát ra tia X khi được chiếu sáng. Ông thử đặt muối uranium dưới ánh sáng mặt trời, khoáng chất này tạo ra lân quang nhìn thấy rõ trên ảnh chụp.
Một hôm, Becquerel chuẩn bị phơi nắng tấm film chụp ảnh và muối uranium nhưng hôm đó trời u ám, ông đành phải cất bộ thử nghiệm vào ngăn kéo.
Hai hôm sau, khi thời tiết tốt hơn, ông đem ra phơi và thật ngạc nhiên, những tấm film trong tủ, không có ánh sáng lại lên hình, thấy rõ các vệt ở chỗ muối. Đó là hiện tượng phóng xạ tự nhiên.
Như vậy, nguyên tử vốn được cho là không thể chia nhỏ và tồn tại vĩnh cửu lại có thể “chết ”… vì bức xạ tự nhiên. Phát hiện này đã làm đảo lộn tư tưởng của các nhà khoa học vì nó trái ngược với nhiều nguyên lý trước đó.
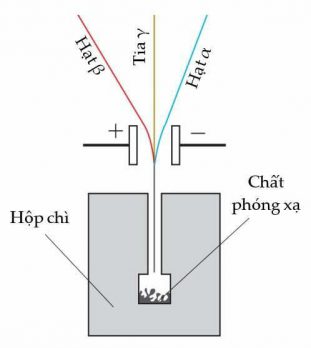
Ernest Rutherford đã xác định được hai loại bức xạ từ vật liệu phóng xạ là bức xạ alpha (α) và bức xạ beta (β).
Hạt alpha mang hai đơn vị cơ bản của điện tích dương và có cùng khối lượng với nguyên tử heli, tính chất của hạt này giống với ion dương.
Hạt beta mang điện tích âm được tạo ra bởi những thay đổi xảy ra bên trong hạt nhân của các nguyên tử phóng xạ và có tính chất giống với electron.
Dạng bức xạ thứ ba, không bị điện trường hay từ trường ảnh hưởng, được phát hiện vào năm 1900 bởi Paul Villard. Bức xạ này được gọi là tia gamma (γ), nó không được tạo thành từ các hạt, nó là bức xạ điện từ có khả năng xuyên thủng và ion hóa cực cao. Cả ba dạng phóng xạ trên được minh họa trong hình bên.
3. Sự phám phá ra proton và neutron (cấu tạo nguyên tử bên trong)
Năm 1909, Rutherford cùng trợ lý Hans Geiger đã thực hiện các nghiên cứu sử dụng hạt α để bắn phá nguyên tử. Dựa vào mô hình của Thomson, ông dự đoán hầu hết hạt sẽ xuyên qua các vật mỏng, nhưng vài hạt bị phân tán hoặc lệch hướng khi gặp electron. Bằng cách nghiên cứu các phân tán này, ông hy vọng tìm ra điều gì đó về sự phân bố của electron trong nguyên tử.
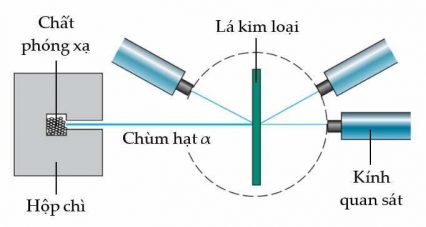
Khi bắn phá các lá vàng rất mỏng, họ đã quan sát thấy:
- Phần lớn các hạt xuyên qua và không bị lệch hướng.
- Một số hạt bị lệch hướng nhẹ.
- Một số ít hạt bị lệch hướng lớn khi xuyên qua.
- Một số bật ngược lại hướng ban đầu.
Sự phân tán góc lớn hơn dự đoán làm cho Rutherford khá bối rối, ông nhận xét điều này giống như bắn một quả pháo 15 inch vào một mảnh giấy lụa nhưng nó quay trở lại trúng vào người bắn.
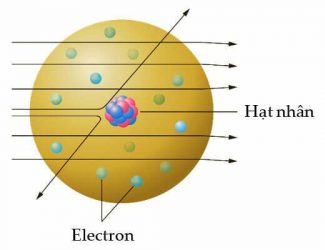
Đến năm 1911, Rutherford đã giải thích được điều này dựa trên một mô hình cấu tạo nguyên tử mới có những đặc điểm sau:
- Phần lớn khối lượng và điện tích dương của nguyên tử đều tập trung ở một vùng rất nhỏ ở trung tâm gọi là hạt nhân. Phần còn lại của nguyên tử chủ yếu là không gian trống.
- Các nguyên tử khác nhau có độ lớn của điện tích dương khác nhau và xấp xỉ bằng một nửa trọng lượng nguyên tử của nguyên tố đó.
- Có bao nhiêu electron ở ngoài hạt nhân thì bên trong hạt nhân có bấy nhiêu điện tích dương. Các nguyên tử nói chung đều trung hòa về điện.
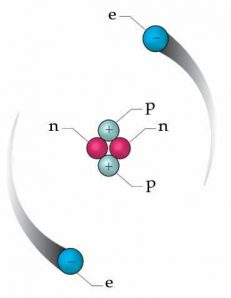
Cấu tạo nguyên tử hạt nhân của Rutherford đã gợi ý về sự tồn tại của các hạt mang điện tích dương nằm trong hạt nhân nguyên tử. Vào năm 1919, chính ông đã phát hiện ra các hạt mang điện tích dương này lúc đang nghiên cứu sự tán xạ của hạt α đập vào các nguyên tử nitrogen trong không khí. Những hạt này được đặt tên là proton.
Năm 1932, James Chadwick đã phát hiện ra một bức xạ xuyên thấu mới gồm các chùm hạt không mang điện và có nguồn gốc từ hạt nhân nguyên tử được gọi là neutron. Vậy qua khoảng 100 năm, chúng ta đã có được mô hình cấu tạo nguyên tử gần như hoàn chỉnh như hình bên.

Ba nhà khoa học tìm ra thành phần của nguyên tử là thầy trò của nhau. Thomson là thầy của Rutherford, tìm ra electron và nhận giải Nobel vật lý năm 1906. Rutherford là thầy của Chadwick, tìm ra proton và nhận giải Nobel hóa học năm 1908. Chadwick tìm ra neutron và nhận giải Nobel vật lý năm 1935.
4. Tính chất của các hạt cơ bản
Số hạt proton trong một nguyên tử được gọi là số hiệu nguyên tử hoặc số proton, ký hiệu là Z. Số hạt electron trong một nguyên tử cũng bằng Z vì tất cả nguyên tử trung hòa về điện. Tổng số hạt proton và neutron trong nguyên tử được gọi là số khối, ký hiệu là A. Một electron mang một đơn vị điện tích âm, một proton mang mang một đơn vị điện tích dương, còn neutron thì không mang điện.
Bảng sau đây trình bày tóm tắt về điện tích và khối lượng của các hạt cơ bản trong cấu tạo nguyên tử:
| Hạt | Điện tích | Khối lượng |
| Proton | +1.6022×10–19 C | 1.6726×10–24 g = 1.0073 u |
| Neutron | 0 | 1.6749×10–24 g = 1.0087 u |
| Electron | –1.6022×10–19 C | 9.1094×10–28 g = 0.00054858 u |
Một đơn vị khối lượng nguyên tử, ký hiệu là u, được định nghĩa chính xác bằng 1/12 khối lượng của một nguyên tử carbon–12.
Ba hạt hạ nguyên tử trên liên quan đến các hiện tượng mà ta quan tâm trong hóa học. Tuy nhiên, chỉ có electron là hạt cơ bản thực sự, vật lý hiện đại ngày nay xem neutron và proton được tạo từ các hạt khác nhỏ hơn nữa.
Luyện tập Cấu tạo nguyên tử
Các quan sát sau là của thí nghiệm với 5 giọt dầu tương tự của Millikan. Giọt 1 mang điện tích là 1.28×10–18 C, các giọt 2 và 3 đều mang một nửa điện tích của giọt 1, giọt 4 mang 1/8 điện tích của giọt 1, giọt 5 mang điện tích gấp 4 lần giọt 1. Những dữ liệu này có nhất quán với giá trị điện tích cơ bản là e = 1.6022×10–19 C không? Làm cách nào mà Millikan suy ra được giá trị điện tích của một electron từ chuỗi dữ liệu rất nhiều giọt dầu như trên? Giải thích.
Đầu tiên, tính cụ thể giá trị điện tích của từng giọt và so sánh với e như sau:
Giọt 1: q1 = 1.28×10–18 C = 7.99e ≈ 8e
Giọt 2 và 3: q2 = q3 = 1.28×10–18 C : 2 = 6.40×10–19 C = 3.99e ≈ 4e
Giọt 4: q4 = 1.28×10–18 C : 8 = 1.60×10–19 C = 0.999e ≈ 1e
Giọt 5: q5 = 1.28×10–18 C × 4 = 5.12×10–18 C = 31.9e ≈ 32e
Có thể thấy những giá trị đều này phù hợp với điện tích mà Millikan tìm thấy cho electron.
Ông có thể suy ra điện tích chính xác từ những dữ liệu này, vì chúng đều là bội số nguyên của e và không có ước số chung nào nhỏ hơn.
Khi thực hiện lại thí nghiệm giọt dầu của Millikan, ghi nhận được kết quả 5 giọt dầu: giọt 1 mang điện tích là 6.41×10–19 C, giọt 2 mang điên tích bằng 1/2 giọt 1, giọt 3 mang gấp đôi điện tích giọt 1, giọt 4 mang điện tích là 1.44×10–18 C và giọt 5 mang điện tích bằng 1/3 giọt 4. Những dữ liệu này có nhất quán với giá trị điện tích cơ bản là e = 1.6022×10–19 C không? Làm cách nào mà Millikan suy ra được giá trị điện tích của một electron từ chuỗi dữ liệu rất nhiều giọt dầu như trên? Giải thích.
Đầu tiên, tính cụ thể giá trị điện tích của từng giọt và so sánh với e như sau:
Giọt 1: q1 = 6.41×10–19 C = 4.00e ≈ 4e
Giọt 2: q2 = 6.41×10–19 C : 2 = 3.21×10–19 C = 2.00e ≈ 2e
Giọt 3: q3 = 6.41×10–19 C × 2 = 1.28×10–18 C = 7.99e ≈ 8e
Giọt 4: q4 = 1.44×10–18 C = 8.99e ≈ 9e
Giọt 5: q5 = 1.44×10–18 C : 3 = 4.80×10–19 C = 3.00e ≈ 3e
Có thể thấy những giá trị đều này phù hợp với điện tích mà Millikan tìm thấy cho electron.
Ông có thể suy ra điện tích chính xác từ những dữ liệu này, vì chúng đều là bội số nguyên của e và không có ước số chung nào nhỏ hơn.
Cho bảng điện tích và khối lượng của các hạt cơ bản sau:
| Hạt | Điện tích | Khối lượng |
| Proton | +1.6022×10–19 C | 1.6726×10–24 g = 1.0073 u |
| Neutron | 0 | 1.6749×10–24 g = 1.0087 u |
| Electron | –1.6022×10–19 C | 9.1094×10–28 g = 0.00054858 u |
Sử dụng dữ liệu từ bảng trên để chứng minh rằng
(a) khối lượng của electron bằng 1/2000 khối lượng của nguyên tử hydrogen (gồm 1 proton và 1 electron).
(b) tỷ lệ khối lượng trên điện tích của proton lớn hơn đáng kể so với electron.
(a) mH / me = (mp + mn) / me = (1.0073 u + 0.00054858 u) / 0.00054858 u = 1827.1 (gần với 2000).
(b) (m/e p) / (m/e e) = mp / me = 1.0073 u / 0.00054858 u = 1836.2.
Tính tỷ lệ khối lượng trên điện tích theo g/C của các ion 127I– (Z = 53, A = 127 và mang một điện tích âm) và 32S2– (Z = 16, A = 32 và mang hai điện tích âm). Các giá trị này là chính xác hay chỉ gần đúng?
Số hiệu nguyên tử Z là số proton (p) và cũng là số electron (e) còn số khối A là tổng số proton (p) và neutron (n) của một nguyên tử, từ đó tính được số neutron là A – Z.
Trong 127I– có p = e = 53, n = 127 – 53 = 74
⇒ m/e = [53×(1.6726×10–24 g + 9.1094×10–28 g) + 74×1.6749×10–24 g] / 1.6022×10–19 C = 1.3272×10–3 g/C
Trong 32S2– có p = e = 16, n = 32 – 16 = 16
⇒ m/e = 16×(1.6726×10–24 g + 9.1094×10–28 g + 1.6749×10–24 g) / (2×1.6022×10–19 C) = 1.6719×10–3 g/C
Các giá trị này là gần đúng, vì khối lượng hạt nhân luôn ít hơn một chút so với tổng khối lượng các hạt proton và neutron (độ hụt khối sẽ học trong bài phản ứng hạt nhân).
