Nguyên tố và đồng vị là bài giảng số 3 của chủ đề Nguyên tử và bảng tuần hoàn – Hóa đại cương 1 của Hóa ĐH, ngay sau bài 2 – Cấu tạo nguyên tử.
Nguyên tố là khái niệm dùng để chỉ tập hợp các nguyên tử có cùng số hiệu nguyên tử, Z, nghĩa là chúng cùng số proton. Mỗi nguyên tố có một tên và một ký hiệu riêng. Ký hiệu hóa học là một hoặc hai chữ cái viết tắt của tên (thường dựa trên tiếng Anh).
Chữ cái đầu của biểu tượng được viết hoa, ví dụ carbon (C), oxygen (O), neon (Ne) và silicon (Si). Một số nguyên tố được biết đến từ thời cổ đại được ký hiệu dựa trên tên tiếng Latinh của chúng như Fe cho sắt (ferrum) và Pb cho chì (plumbum), Na cho sodium (natrium), K cho potassium (kalium), ngoài ra vonfram ký hiệu là W, dựa vào từ wolfram trong tiếng Đức.
Một số nguyên tố có số hiệu lớn không tìm thấy ở ngoài tự nhiên mà phải được tổng hợp trong máy gia tốc hạt trong điều kiện giới hạn, một vài trong số đó chỉ tồn tại ở một thời điểm. Không thể tránh khỏi những tranh cãi về việc nhóm nghiên cứu nào phát hiện ra nguyên tố mới. Đến nay, đã đạt được thỏa thuận quốc tế về 114 nguyên tố (năm 2017), mỗi nguyên tố đều có tên và ký hiệu chính thức, các nguyên tố có thứ tự là 113, 115, 117 và 118 vẫn chưa thống nhất.
1. Hiện tượng đồng vị
Để đại diện cho thành phần của từng nguyên tử, ta ký hiệu số proton là p, số neutron là n và số electron là e và đặt nó vào phía trước ký hiệu nguyên tố như sau:
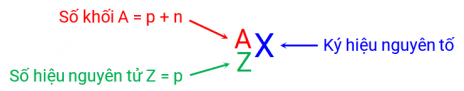
Trái với những gì Dalton nghĩ, các nguyên tử của cùng một nguyên tố không nhất thiết phải cùng khối lượng. Năm 1912, Thomson đo được tỷ lệ khối lượng trên điện tích của các ion dương hình thành từ các nguyên tử neon. Từ những tỉ lệ này ông đã suy ra khoảng 91% các nguyên tử có khối lượng giống nhau, còn lại khoảng 10% nặng hơn bình thường. Tất cả các nguyên tử neon đều có 10 proton trong hạt nhân, và hầu hết có 10 neutron. Một phần nhỏ các nguyên tử neon có 11 neutron hay 12 neutron. Có thể biểu diễn ba loại nguyên tử neon khác nhau này như sau:
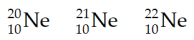
Vì các nguyên tử Ne đều có 10 proton nên đa số khi viết thường lược bỏ Z thành 20Ne, 21Ne và 22Ne.
Các nguyên tử có cùng số hiệu nguyên tử (Z) nhưng khác nhau về số khối (A) được gọi là đồng vị của nhau. Trong số toàn bộ nguyên tử Ne trong Trái Đất, có 90.51% là còn lại phần trăm của 21Ne và 22Ne lần lượt là 0.27% và 9.22%. Phần trăm của các đồng vị trên dựa trên số lượng, không phải khối lượng. Thỉnh thoảng, các số khối của các đồng vị được ghép vào tên của nguyên tố để nói tắt cho loại đồng vị đó, ví dụ neon–20, neon–21, neon–22.
Một vài nguyên tố trong tự nhiên chỉ bao gồm một loại nguyên tử, không xuất hiện các đồng vị. Ví dụ như nhôm chỉ gồm các nguyên tử nhôm–27 ngoài tự nhiên. Thường thì các đồng vị cùng chia sẻ với nhau tên gọi và ký hiệu hóa học ngoại trừ hydrogen. Đồng vị 2H có tên gọi riêng là deuterium (ký hiệu là D), còn đồng vị 3H có tên gọi riêng là tritium (ký hiệu là T).
2. Khái niệm ion
Khi các nguyên tử mất đi hoặc nhận được một hay một vài electron, các phần tử hình thành được gọi là các ion, chúng mang các điện tích thuần. Electron mang điện tích âm nên khi thêm electron vào một nguyên tử trung hòa sẽ tạo ra một ion tích điện âm. Ngược lại, lấy electron ra khỏi nguyên tử sẽ tạo ra một ion tích điện dương.
Ví dụ 20Ne+ và 22Ne2+ là các ion. Ion đầu tiên có 10 proton, 10 neutron và 9 electron. Ion thứ hai cũng có 10 proton nhưng có đến 12 neutron và 8 electron. Điện tích trên mỗi ion bằng số proton trừ cho số electron.
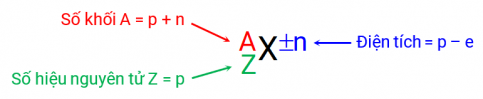
Các ion mang điện tích dương được gọi tắt là cation còn các ion mang điện tích âm được gọi tắt là anion. Ví dụ anion 16O2– có 8 proton (Z), 8 neutron (A – Z) và 10 electron (–2 = 8 – 10).
3. Khối lượng đồng vị
Chúng ta không thể xác định được khối lượng của các nguyên tử riêng lẻ bằng cách cộng khối lượng của các hạt cơ bản lại vì khi proton và neutron kết hợp tạo thành hạt nhân, một phần rất nhỏ khối lượng ban đầu chuyển thành năng lượng liên kết và giải phóng ra ngoài. Tuy nhiên, ta lại không dự đoán chính xác được năng lượng liên kết này là bao nhiêu. Do đó, khối lượng các nguyên tử riêng lẻ được xác định bằng thực nghiệm.
Theo quy ước quốc tế, nguyên tử carbon–12 được chọn làm khối lượng tiêu chuẩn, khối lượng của nó được gán bằng 12 đơn vị khối lượng nguyên tử, tức là 12 u. Hình sau đây mô tả quá trình xác định khối lượng nguyên tử của thủy ngân bằng khối phổ kế.
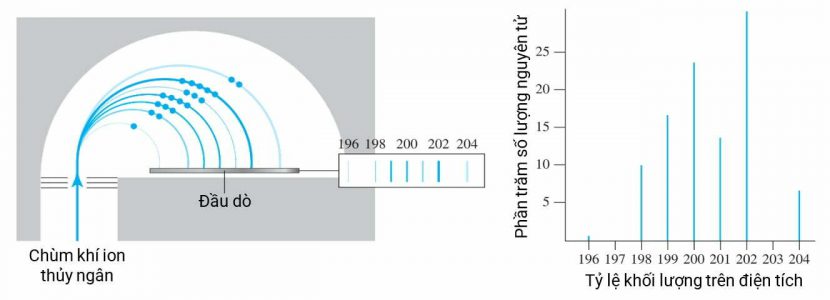
Đầu tiên hơi thủy ngân được ion hóa bằng cách bắn phá electron tạo ra nhiều loại ion, các ion này được chọn lọc bằng điện trường và từ trường, chỉ những ion mang một điện tích dương được vào trong. Các ion này bị từ trường làm lệch hướng thành những đường tròn, tùy vào khối lượng nặng hay nhẹ mà chúng đập vào đầu dò ở những vị trí khác nhau. Càng nhiều ion đập vào thì phản ứng của đầu dò càng lớn. Từ cường độ phản ứng của đầu dò này mà tính được phần trăm các đồng vị thủy ngân.
Mặc dù số khối (A) là một số nguyên, khối lượng thực tế của các nguyên tử (tính theo u) không bao giờ là các số nguyên, ngoại trừ carbon–12. Tuy nhiên, chúng có giá trị rất gần với các số khối. Ví dụ đồng vị oxygen–16, từ dữ liệu phổ khối lượng, tỉ lệ khối lượng 16O so với 12C là 1.33291. Do đó khối lượng của nguyên tử oxygen–16 là 1.33291×12 u = 15.9949 u (rất gần 16).
4. Khối lượng nguyên tử
Cần phải làm rõ sự khác nhau của số khối, nguyên tử khối và khối lượng nguyên tử chuẩn. Số khối là tổng số proton và neutron trong một nguyên tử, nó là số đếm nên không có đơn vị. Nguyên tử khối là khối lượng của một nguyên tử tính theo đơn vị khối lượng nguyên tử (u) được quy ước là 1 u bằng 1/12 khối lượng một nguyên tử carbon–12. Khối lượng nguyên tử của một nguyên tố là trung bình cộng nguyên tử khối của tất cả nguyên tử nguyên tố đó trên Trái Đất. Giá trị này được tính thông qua nguyên tử khối và sự phổ biến của các đồng vị theo công thức:

Đối với một số nguyên tố, phần trăm số lượng đồng vị thay đổi từ mẫu này sang mẫu khác. Ví dụ giá trị cao nhất về phần trăm đồng vị carbon–13 là 1,1466% (trong các mẫu nước biển sâu) và thấp nhất là 0,9629% (từ các mẫu crocetene ở đáy Bắc Thái Bình Dương). Vì sự khác biệt này, nguyên tử khối thực nghiệm của carbon nằm trong khoảng giới hạn như bảng dưới. Đối với những nguyên tố này, IUPAC cung cấp khối lượng nguyên tử quy ước để dễ sử dụng khi cần.
| Số hiệu nguyên tố | Ký hiệu hóa học | Khối lượng nguyên tử, u | |
| Quy ước | Khoảng | ||
| 1 | H | 1.008 | [1.00784, 1.00811] |
| 3 | Li | 6.94 | [6.938, 6.997] |
| 5 | B | 10.81 | [10.806, 10.821] |
| 6 | C | 12.011 | [12.0096, 12.0116] |
| 7 | N | 14.007 | [14.00643, 14.00728] |
| 8 | O | 15.999 | [15.99903, 15.9997] |
| 12 | Mg | 24.305 | [24.304, 24.307] |
| 14 | Si | 28.085 | [28.084, 28.086] |
| 16 | S | 32.06 | [32.059, 32.076] |
| 17 | Cl | 35.45 | [35.446, 35.457] |
| 35 | Br | 79.904 | [79.901, 79.907] |
Có sự khác nhau về số chữ số có nghĩa trong khối lượng của các nguyên tử giữa các nguyên tố. Ví dụ khối lượng nguyên tử của fluorine là 18,9984032 u, chính xác hơn nhiều so với krypton là 83.798 u. Điều này là do chỉ có một loại nguyên tử fluorine trong tự nhiên là fluorine–19 còn krypton có đến sáu đồng vị tự nhiên và sự phân bố phần trăm của chúng khác nhau từ mẫu này sang mẫu khác.
Cho một nguyên tử 108Pd (Z = 46) có khối lượng là 107.90389 u, xác định
(a) số proton, số neutron và số electron trong nguyên tử này.
(b) tỷ lệ khối lượng của nguyên tử này so với carbon–12.
Từ ký hiệu ⟹ Z = 46 và A = 108.
(a) Số proton (p) = số electron (e) = Z = 46, số neutron (n) = A – Z = 62.
(b) Tỷ lệ khối lượng của nguyên tử 108Pd so với 12C là 107.90387 u / 12 u = 8.9919908.
Cho ion 228Ra2+ (Z = 88) có khối lượng là 228.030 u, xác định
(a) số proton, số neutron và số electron trong ion này.
(b) tỷ lệ khối lượng của ion này so với oxygen–16 (15.9949 u).
Từ ký hiệu ⟹ Z = 88 và A = 228.
(a) Số proton (p) = Z = 88, số electron (e) = Z – 2 = 86 và số neutron (n) = A – Z = 140.
(b) Tỷ lệ khối lượng của ion 228Ra2+ so với 16O là 228.030 u / 15.9949 u = 14.2564.
Tỷ lệ khối lượng hai đồng vị tự nhiên của nguyên tố indium là 1.0177 : 1. Đồng vị nặng hơn trong hai đồng vị này nặng gấp 7.1838 lần khối lương của oxygen–16 (15.9949 u). Xác định khối lượng của hai đồng vị trên theo u.
Khối lượng nguyên tử indium nặng hơn là: mIn (1) = 16×m16O = 114.90 u.
Khối lượng nguyên tử indium nhẹ hơn là: mIn (2) = mIn (1) ÷ 1.0177 = 112.90 u.
Hoàn thành các ô trống trong bảng sau:
Ký hiệu | Điện tích | Số proton | Số electron | Số neutron | Số khối |
| 24Mg (Z = 12) | 0 | 12 | 12 | 12 | 24 |
[ ………. ] | [ ….. ] | 14 | 14 | 14 | [ ….. ] |
[ ………. ] | 1– | 35 | [ ….. ] | [ ….. ] | 79 |
[ ………. ] | 1+ | [ ….. ] | 2 | [ ….. ] | 7 |
[ ………. ] | [ ….. ] | 16 | 18 | [ ….. ] | 32 |
| 20Ne2+ (Z = 10) | [ ….. ] | [ ….. ] | [ ….. ] | [ ….. ] | [ ….. ] |
Ký hiệu | Điện tích | Số proton | Số electron | Số neutron | Số khối |
| 24Mg (Z = 12) | 0 | 12 | 12 | 12 | 24 |
[ 28Si (Z = 14) ] | [ 0 ] | 14 | 14 | 14 | [ 28 ] |
[ 79Br– (Z = 35) ] | 1– | 35 | [ 36 ] | [ 44 ] | 79 |
[ 7Li+ (Z = 3) ] | 1+ | [ 3 ] | 2 | [ 4 ] | 7 |
[ 32S2– (Z = 16) ] | [ 2– ] | 16 | 18 | [ 16 ] | 32 |
| 20Ne2+ (Z = 10) | [ 2+ ] | [ 10 ] | [ 8 ] | [ 10 ] | [ 20 ] |
