Chất chỉ thị pH là các hợp chất thay đổi màu sắc theo pH của môi trường được dùng để nhận biết định tính nhanh tính acid, base hay trung hòa.
Chỉ thị pH có hai dạng chính đó là dạng dung dịch và dạng giấy tẩm (dung dịch chỉ thị được tẩm lên giấy sau đó được làm khô).
– Đối với dạng giấy thường được sử dụng bằng cách nhúng và rút ra khỏi dung dịch hoặc cho một giọt dung dịch muốn thử lên trên giấy tẩm sau đó so sánh màu sắc giấy với màu chuẩn (ứng với mỗi khoảng pH thì chỉ thị sẽ có một màu sắc nhất định) từ đó xác định được khoảng pH của dung dịch.
– Đối với dạng lỏng thì thường sẽ được thêm trực tiếp vào lượng nhỏ dung dịch, tiếp đó tiến hành quan sát sự biến đổi màu sắc của dung dịch, tương tự như giấy tẩm tiến hành so sánh với màu chuẩn thì ta sẽ biết được khoảng pH của dung dịch.
Thông thường dạng giấy tẩm chỉ thị được sử dụng phổ biến hơn do tính tiện dụng, giá rẻ, dễ tìm mua trên thị trường và cần lượng nhỏ dung dịch cần đo do đó không làm tốn nhiều dung dịch cần xác định pH, dạng dung dịch chỉ thị thường được sử dụng trong chuẩn độ nhiều hơn.
Bài đọc thêm thuộc chương trình Hóa 11 và Hóa phân tích.
1. pH là gì?
Độ pH có thể được hiểu là mức độ hoạt động của các ion H+ có trong dung dịch dưới sự tác động bởi một hằng số điện ly. pH là một giá trị lý thuyết được tính bằng −log[H3O+], nó giúp đưa nồng độ H+ thành các trị số cụ thể để mọi người dễ dàng nhận biết và so sánh được. Độ pH của các phân tử có trong dung dịch được quy ước như sau:
- Độ pH ≈ 7 là môi trường trung tính (thường là nước)
- Độ pH > 7 là môi trường acid yếu
- Độ pH < 7 là môi trường acid mạnh
2. Tại sao các chỉ thị lại có hiện tượng thay đổi màu sắc?
Hiện tượng thay đổi màu sắc là hiện tượng đơn giản nhất mà chúng ta có thể quan sát và nhận ra sự thay đổi trong dung dịch ngay lập tức.
Màu sắc của dung dịch xuất hiện là do chúng hấp thu một số bước sóng trong vùng ánh sáng khả kiến và phản xạ lại các bước sóng không bị hấp thu, các bước sóng này phối trộn lại tạo nên màu sắc khi quan sát bằng mắt thường. Các hợp chất hữu cơ có nhiều màu sắc khác nhau là do các hệ pi liên hợp trong phân tử có khả năng hấp thụ các bước sóng đặc trưng và do việc sắp xếp các hệ pi liên hợp trong khung phân tử sẽ tạo ra các màu sắc khác nhau.
Chúng ta cũng đã biết các chỉ thị đa phần là acid yếu, tùy vào các cấu trúc đặc biệt của mỗi loại chỉ thị và dạng cân bằng qua lại giữa dạng acid và dạng base liên hợp của chúng sẽ tạo ra sự đa dạng về màu sắc cũng như đa dạng các khoảng chỉ thị khác nhau.

HIn: dạng acid của chỉ thị pH
In–: dạng base liên hợp của chỉ thị pH
Do đây phương trình tồn tại ở dạng cân bằng do đó nó tuân theo nguyên lý Le Chatelier. Khi [H3O+] tăng hoặc giảm, cân bằng sẽ dịch chuyển sang phải hoặc trái tương ứng và tùy vào dạng phối trộn màu sắc đặc trưng của hai dạng acid và base liên hợp của chỉ thị so với điều kiện chuẩn chúng ta có thể biết được dung dịch đang nằm trong khoảng pH nào.
3. Một số loại chỉ thị phổ biến
3.1. Phenolphtalein
Phenolphtalein là một hợp chất hóa học với công thức C20H14O4, có công thức phân tử như hình, nó được phát hiện lần đầu tiên bới Adolf von Baeyer. Nó được tổng hợp bằng phản ứng ngưng tụ 2 phân tử phenol vào phthalic anhydride dưới tác động của nhiệt độ và xúc tác H2SO4.
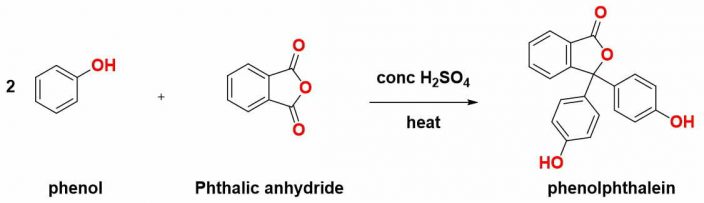
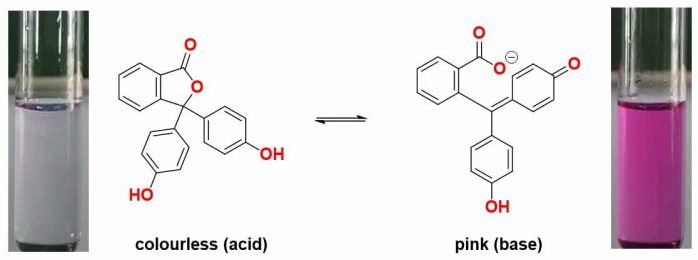
Phthalein đã được chứng minh là có cân bằng theo pH môi trường được đề cập ở hình dưới, tùy cách sắp xếp hệ cộng hưởng của các electron mà phenolphthalein có thể thay đổi thành các màu sắc: cam (pH < 0), không màu (pH từ 0 – 8), màu tím (pH từ 8 – 12) và cuối cùng là không màu (pH > 12). Trước đây phenolphthalein đã từng được sử dụng làm thuốc nhuận tràng tuy nhiên, do các quan ngại về gây ung thư do đó nó đã bị cấm sử dụng. Hiện nay phenolphthalein được sử dụng phổ biến để ứng dụng làm chỉ thị pH trong chuẩn độ acid base.
3.2. Giấy quỳ tím (thảo lam)
Sở dĩ có tên gọi là thảo lam là vì:
Thảo nghĩa là cỏ (thảo mộc, thảo lư) vì được ly trích từ một loại thực vật giống như cỏ gọi là địa y
Lam có nghĩa là màu lam
Thảo lam chính là màu lam ly trích từ một loại cỏ (xem thêm bài viết của GS Lê Ngọc Thạch ở đây).
Thảo lam thương mại, dạng bột, màu xanh đen. Ly trích từ địa y chủ yếu từ loài Roccalla tinctoria, cấu tử chính trong hỗn hợp là 7-hydroxyphenoxazone. Ủy ban soạn thảo Danh từ Chuyên môn và Thầy Lê Văn Thới đã phiên dịch chữ “litmus” là “thảo lam” trong quyển Danh từ Hóa học (1963) trang xxvi. Ra đời vào khoảng năm 1300, từ nhà giả kim thuật (alchemist) người Tây Ban Nha, Arnaldus de Villa Nova.
Cách chế tạo giấy thảo lam:
Đầu tiên hòa tan bột thảo lam vào nước trung hòa, thu được dung dịch có màu lam. Sau đó, chia làm hai. Acid hóa một nửa dung dịch cho ra dung dịch có màu đỏ. Và base hóa nhẹ nửa dung dịch còn lại cho ra dung dịch có màu xanh dương rõ. Nhúng giấy lọc vào mỗi dung dịch, ngâm, kẹp lên dây, phơi khô. Xong rồi, cắt ra thành từng miếng giấy nhỏ, bề ngang độ 8 − 10 mm, dài độ 4 − 5 cm, gọi là “giấy thảo lam đỏ” và “giấy thảo lam xanh”.

Giấy thảo lam đỏ (red litmus paper) dùng để thử tính baz, pH từ 8,3 trở lên, màu đỏ sẽ chuyển thành màu xanh. Còn giấy thảo lam xanh (blue litmus paper) dùng để thử tính acid, pH từ 4,5 trở xuống, màu xanh sẽ chuyển thành màu đỏ.

Để thử tính acid-base của chất khí, làm ẩm giấy thử trước sau đó đặt ở nơi dòng khí đi qua sẽ dự đoán được tính acid-base của chúng.
3.3. Methyl da cam (heliantin)
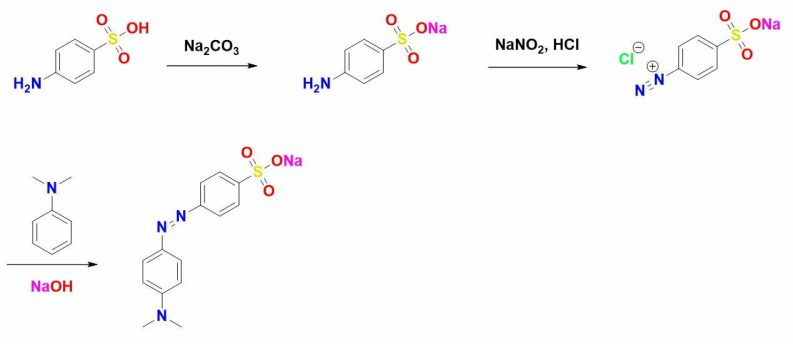
Methyl cam là một loại thuốc nhuộm azo được tìm ra bởi P. Griess (1875), O. N. Witt (1876), Z. Roussin (1876). Sở dĩ nó có tên gọi là thuốc nhuộm azo là do nó có chứa nhóm azo (-N=N-) trong phân tử, nó được tổng hợp thông qua trung gian muối diazonium rất nổi tiếng việc thay đổi amine hoặc các nucleophile đã tạo ra sự đa dạng về màu sắc của các loại thuốc nhuộm này.
Ngoài tác dụng làm phẩm nhuộm thì methyl da cam được ứng dụng rất nhiều trong chuẩn độ acid-base, nó có màu đỏ cam (pH < 3.1), màu vàng (pH ≥ 4.2).
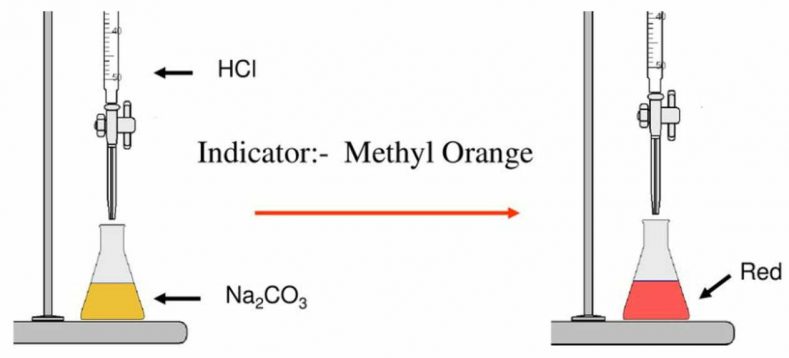
Trong các chuẩn độ acid-base thì methyl da cam thường được dùng nhất trong chuẩn độ Na2CO3 với HCl. Việc có khoảng chuyển màu đặc trưng phù hợp với khoảng nhảy của phản ứng chuẩn độ này giúp cho nó được lựa chọn sử dụng phổ biến trong phòng thí nghiệm và cả trên thi trường.
3.4. Chỉ thị pH trong tự nhiên
Trong thời điểm hiện tại, chỉ số pH nó không còn quá xa lạ đối với chúng ta, nó hiện diện trong rất nhiều lĩnh vực khác nhau như pH của môi trường nuôi tôm, cá, thủy sản, trong dầu gội đầu, trong cơ thể, trong các loại đồ uống. Thực tế, có rất nhiều loại chỉ thị pH được phân lập từ thiên nhiên và do đó có một số loại hoa, cây cỏ có khả năng sử dụng các hợp chất chỉ thị này để thay đổi màu sắc cánh hoa, lá… dựa trên độ pH của đất nơi chúng được trồng.
Hoa hồng, hoa cẩm tú cầu là một ví dụ: ở các vùng đất chua (pH < 5.5) sẽ cho ra các hoa cẩm tú cầu có màu xanh, đất có tính kiềm (pH > 5.5) thường cho ra các hoa có màu hồng, dựa trên các đặc tính đặc biệt này mà người ta có thể điều chỉnh để thu được màu hoa ưng ý nhất.

Đối với các bạn chưa có cơ hội sử dụng hoặc quan sát trực tiếp các loại chỉ thị pH được đề cập ở trên thì chúng ta có thể thực hiện ly trích một loại chỉ thị pH từ các vật liệu an toàn, dễ kiếm ngay tại nhà đó (lưu ý: luôn đeo găng tay và kính bảo hộ để đảm bảo an toàn khi làm thí nghiệm).
Bắp cải tím chứa một loại chỉ thị tự nhiên, nó có khoảng đổi màu rộng từ 0 – 14.
Dụng cụ cần chuẩn bị:
| 1 Bắp cải tím | 1 Giấy lọc |
| 1 Dao cắt | 1 Nồi đun 250 mL |
| Nước sử dụng trong gia đình | |
Các bước thực hiện như sau:
- Bước 1: Cắt nhỏ bắp cải tím (có thể sử dụng máy say sinh tố để xoay nhuyển)
- Bước 2: Cho vào nồi đun bắp cải tím vừa cắt ở trên và thêm nước ngập bắp cải
- Bước 3: Đun 10–15 phút (đến khi phần lớn màu ra khỏi bắp cải) thì ngừng đun và để nguội
- Bước 4: Lọc qua giấy lọc thu phần dung dịch
Dựa trên bốn bước đơn giản phía trên bạn đã thu được chỉ thị pH tại nhà, chúng ta có thể tiến hành thử nghiệm với các dung dịch pH đã biết trước như nước cốt chanh, dung dịch tẩy rửa, giấm ăn, …

4. Một số loại máy đo pH

Giá trị pH ngoài được tính toán lý thuyết thì trên thực tế nó được sử dụng trong rất nhiều ngành nghề: kiểm soát chất lượng, chăn nuôi, … do các anh chị làm việc trong lĩnh vực này có đặc trưng là môi trường làm việc của họ không trong phòng thí nghiệm cũng như độ chính xác trong các phép tính pH đôi lúc xảy ra sai số tuy nhiên là họ lại cần một kết quả nhanh chóng ngay thời điểm đó để đưa ra các giải pháp tiếp theo.
Để giải quyết các vấn đề trên, bút đo pH đã ra đời, trong mười năm trở lại đây việc đo pH có thể đạt được độ chính xác cao lên tới vài số sau dấu phẩy và tốc độ phản hồi nhanh mà tất cả chỉ xảy ra vỏn vẹn trên một thiết bị nhỏ gọn rất thuận tiện cho việc di chuyển và các kết quả thu được sẽ ngay lập tức chuyển sang độ pH hiển thị lên màn hình kỹ thuật số.
Trong ngành kiểm lâm, trắc địa môi trường chỉ số này cho biết đất ngay tại thời điểm đó có bị chua hoặc bị kiềm, hay trong nuôi trồng thủy sản độ pH ảnh hưởng trực tiếp đến môi trường nuôi loại thủy sản đó nhiều loại thủy sản nhạy cảm chỉ có thể tồn tại tốt trong môi trường pH đó, hay trong quản lý hồ hơi pH cao hay thấp hơn ngưỡng trung bình có thể dẫn đến các bệnh trực tiếp về da của người dung, biết chính xác độ pH cho phép người có chuyên môn có thể đưa ra các liệu pháp, giải pháp để khắc phục nhanh các tình huống xấu sẽ xảy ra.
Trong bài viết lần này, mình đã giới thiệu sơ qua cho các bạn về chỉ thị pH, nguyên lý hoạt động, một số loại chỉ thị pH trong phòng thí nghiệm và ngoài tự nhiên, bút đo pH và tính ứng dụng của nó. Mong qua bài viết sẽ đem tới các kiến thức bổ ích về giá trị pH này.
